
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| B. | 2CN-+H2O+CO2═2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | HCOO-和CN-结合H+能力前者小于后者 |
分析 弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,酸的电离平衡常数HCOOH>H2CO3>HCN>HCO3-,则酸根离子水解程度CO32->CN->HCO3->HCOO-,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答 解:酸的电离平衡常数HCOOH>H2CO3>HCN>HCO3-,则酸根离子水解程度CO32->CN->HCO3->HCOO-,
A.酸性强弱顺序是HCOOH>H2CO3>HCN>HCO3-,强酸能和弱酸盐反应生成弱酸,所以反应方程式为:2HCOOH+CO32-=2HCOO-+H2O+CO2↑,故A正确;
B.酸的电离平衡常数越大,酸的酸性越强,强酸能够制取弱酸,所以二者反应生成HCN和HCO3-,离子方程式为:CN-+H2O+CO2═HCN+HCO3-,故B错误;
C.等pH、等体积的HCOOH和HCN,n(HCN)>n(HCOOH),中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;
D.HCOOH>HCN,酸性越强,对应的酸根离子结合氢离子的能力越弱,则HCOO-和CN-结合H+能力前者小于后者,故D正确;
故选B.
点评 本题考查了弱电解质的电离,明确弱电解质电离平衡常数与酸性强弱、酸根离子的水解程度的关系是解本题关系,再结合强酸制取弱酸、酸碱中和反应来分析解答,试题培养了学生的分析能力及灵活应用能力.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 60mL | B. | 45mL | C. | 30mL | D. | 15mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | H2SO3→H2SO4: | 2H2SO3+O2=2H2SO4 |
| B | Fe→Fe3+: | 2Fe+6H+=2Fe3++3H2↑ |
| C | Br-→Br2: | 2Br-+I2=B r2+2I- |
| D | Cu→CuSO4: | Cu+2H2SO4(稀)=CuSO4+SO2↑+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
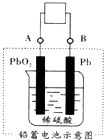 电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:| A. | 放电时电极 PbO2 发生氧化反应 | |
| B. | 放电时电子流向由B到A | |
| C. | 工作时蓄电池里电解质溶液的pH不变 | |
| D. | 充电时阴极反应是PbSO4-2e-+2H2O═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com