
【题目】某无色溶液X中,可能含有Na+、Cu2+、Mg2+、Al3+、SiO32﹣、AlO2﹣、CO32﹣、Cl﹣中的一种或几种.现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列说法中不正确的是( ) 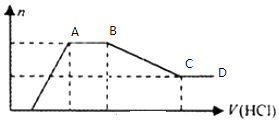
A.溶液X中一定不含Cu2+、Mg2+、Al3+ , 可能含有Cl﹣
B.OA段参加反应的阴离子的物质的量之比为2:1或1:2
C.AB段一定生成了气体
D.BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O
【答案】B
【解析】解:溶液呈无色,说明不含有色离子Cu2+ , 加入稀盐酸时先不生成沉淀,说明溶液中含有先和盐酸反应的离子,AB段加入稀盐酸时不生成沉淀,BC段加入稀盐酸沉淀减少,说明生成的沉淀能和稀盐酸反应生成可溶性物质,CD段加入稀盐酸沉淀不减少,说明含有不溶于稀盐酸的沉淀,则应该含有SiO32﹣;BC段说明含有AlO2﹣ , 溶于中含有SiO32﹣、AlO2﹣ , 说明溶液中不含Mg2+、Al3+ , 根据电荷守恒知,溶液中一定含有Na+ , 根据图知溶液中还含有CO32﹣ , 根据实验现象无法确定是否含有Cl﹣ , A.通过以上分析知,溶液X中一定不含Cu2+、Mg2+、Al3+ , 可能含有Cl﹣ , 故A正确;
B.OA段参加反应的阴离子有SiO32﹣、AlO2﹣ , 因为加入稀盐酸体积未知无法计算两种离子物质的量之比,故B错误;
C.AB段是碳酸氢根离子和氢离子反应生成二氧化碳和水,所以一定生成气体,故C正确;
D.BC段是氢氧化铝和稀盐酸的反应,离子方程式为Al(OH)3+3H+=Al3++3H2O,故D正确;
故选B.


科目:高中化学 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:
2Na2S2+NaBr3 ![]() Na2S4+3NaBr,当闭合K时,X极附近溶液变红色.
Na2S4+3NaBr,当闭合K时,X极附近溶液变红色.
下列说法正确的是( )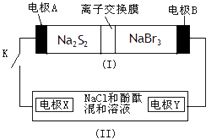
A.装置(I)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为:NaBr3+2Na++2e﹣=3NaBr
C.X电极的电极反应式为:2Cl﹣﹣2e﹣=Cl2↑
D.每有0.1mol Na+通过离子交换膜,X电极上就生成标准状况下气体1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
请回答: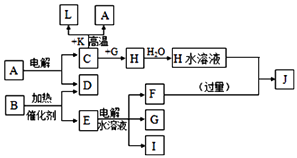
(1)写出E物质的电子式
(2)写出C与K反应的化学方程式 , 该反应的反应物总能量(填“大于”或“小于”)生成物总能量.
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 .
(4)H水溶液中离子浓度由大到小排序
(5)J与H反应的离子方程式为
(6)写出G与熟石灰反应制取漂白粉的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:mA(气)+nB(气)pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是( ) 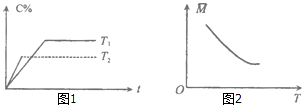
A.m+n>p,△H>0
B.m+n>p,△H<0
C.m+n<p,△H>0
D.m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:mA(气)+nB(气)pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是( ) 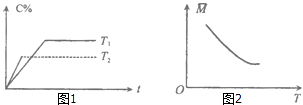
A.m+n>p,△H>0
B.m+n>p,△H<0
C.m+n<p,△H>0
D.m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y是元素周期表前20号元素,且X的原子序数比Y大4.
(1)若X的氧化物、氯化物都是实验室常用的干燥剂.
(i)含有X元素的一种盐溶液和Y的一种气态氧化物均是工农业生产中常见的漂白剂,则等物质的量的二者在水溶液中发生反应的化学方程式为
(ii)酸性土壤改变会施用X的一种气态氧化物,但不能与氮肥同时施用,原因为
(2)若X是金属性最强的短周期元素
(i)单质X着火,可用来灭火.
(ii)Y与氢元素能形成一种摩尔质量为43g/mol的共价化合物,已知该物质受到撞击即可放出大量的气体,写出对应的化学方程式:
(3)若X的离子半径是第三周期离子半径最小的
Y与钙元素形成的化合物的电子式为;Y2与NaOH溶液反应的产物之一是OY2 , 该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定下列各混合物中铝的质量分数,设计了如下实验方案:
①铜铝混合物 ![]() 充分反应测定生成气体的体积
充分反应测定生成气体的体积
②铜铝混合物 ![]() 充分反应测定剩余固体的质量
充分反应测定剩余固体的质量
③铜铝混合物 ![]() 充分反应测定所得固体的质量
充分反应测定所得固体的质量
④铁铝混合物 ![]() 充分反应测定生成气体的体积
充分反应测定生成气体的体积
以上方案可行的是( )
A.①②③
B.②③④
C.①③④
D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com