
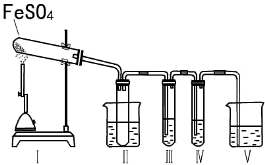
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
分析 (1)亚铁离子易被氧化具有还原性,在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],原子守恒和电子守恒配平书写化学方程式;
(2)①安全瓶的作用是可以防止倒吸;当温度高于44.8°C时三氧化硫为气体状态;
②装置III是检验是否有三氧化硫,装置IV是检验是否有二氧化硫,根据二者的性质选择试剂;
③二氧化硫会污染空气,要用氢氧化钠溶液来处理尾气;
④检验三价铁离子用硫氰化钾溶液;检验二价铁离子用K3[Fe(CN)6]溶液;
⑤反应过程中FeSO4固体分解为二氧化硫、三氧化硫、FeO、Fe2O3,完全分解后得到11.2g固体为氧化铁和氧化亚铁,质量减少的为二氧化硫和三氧化硫的总质量,据此列方程组计算.
解答 解:(1)亚铁离子具有还原性,易被氧气氧化,反应方程式为:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O,
故答案为:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O;
(2)①SO3的沸点是44.8°C,当温度高于44.8°C时三氧化硫为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固,产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中(或安全瓶),
故答案为:50℃;防止产生倒吸(或“用作安全瓶”);
②装置III是检验是否有三氧化硫,可以选用氯化钡溶液,如果有白色沉淀生成说明有三氧化硫;装置IV是检验是否有二氧化硫,二氧化硫能使品红褪色,也能使酸性高锰酸钾溶液褪色,所以可以选用二者来检验二氧化硫;
故答案为:C;产生白色沉淀;B、E;
③二氧化硫会污染空气,所以要用氢氧化钠溶液来吸收剩余的二氧化硫,其反应的离子方程式为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
④检验三价铁离子用硫氰化钾溶液,溶液变红色,证明有三价铁离子,进而说明固体产物中含有氧化铁;检验二价铁离子用K3[Fe(CN)6]溶液,溶液中生成蓝色沉淀,说明有二价铁离子,即证明固体产物中含有FeO;
故答案为:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | |
| 固体中含有FeO |
点评 本题主要考查了学生亚铁离子和三价铁离子之间的相互转化,题目综合性较强,掌握基础是解题关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | H2A是弱酸 | |
| B. | 稀释0.1 mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大 | |
| C. | 在0.1 mol/L的H2A溶液中,c(H+)=0.12 mol/L | |
| D. | 若0.1 mol/L NaHA溶液中c(H+)=0.02 mol/L,则0.1 mol/L的H2A中c(H+)<0.12 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
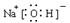 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
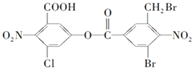 根据所学,回答下列问题:
根据所学,回答下列问题: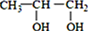 <
< 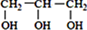 (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)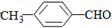 <
<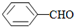
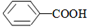 >CH3COOH.
>CH3COOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 含氧官能团名称 | |||
| 含氧官能团数目 |
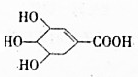 ”,你认为这种结构是否存在:是,该物质在一定条件下能(填“能”或“不能”)发生分子内的酯化反应,作出此判断的理由是含有羟基和羧基.
”,你认为这种结构是否存在:是,该物质在一定条件下能(填“能”或“不能”)发生分子内的酯化反应,作出此判断的理由是含有羟基和羧基.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

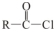 +R′OH→
+R′OH→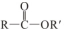 +HCl
+HCl
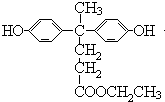 .
.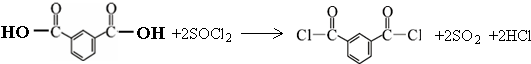 .
. 的路线.
的路线.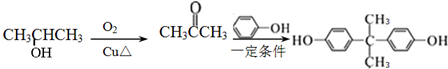 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸能导电,所以盐酸是电解质 | |
| B. | 纯碱的化学式:NaOH | |
| C. | 碳酸钾的电离方程式:K2CO3=2K+1+CO3-2 | |
| D. | 氯离子的结构示意图为: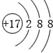 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com