
| A、H2 | B、Fe |
| C、Cu | D、Ag |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| A、过滤、蒸发、蒸馏、萃取(或分液或萃取、分液) |
| B、过滤、蒸馏、蒸发、萃取 |
| C、蒸发、蒸馏、过滤、萃取 |
| D、萃取、蒸馏、蒸发、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、①③ | C、③④ | D、①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂可以增大正反应速率,减小逆反应速率 |
| B、使用催化剂可以使化学平衡向正反应方向移动 |
| C、使用催化剂可以降低反应的活化能 |
| D、使用催化剂可以改变反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 样品起始质量-a点固体质量 |
| 样品起始质量 |
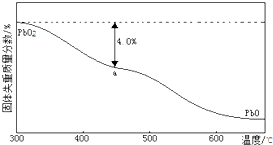
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PCl3、NH3、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B、1mol SiO2 中含有2mol共价键 |
| C、NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
| D、原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com