
| A. |  装置:可在瓶中先装入某种液体收集NO气体 | |
| B. |  装置:可用图示的方法能检査此装置的气密性 | |
| C. |  装置:用来证明氯的非金属性比硅强 | |
| D. |  装置:橡皮管的作用是能使水顺利流下 |
分析 A.NO不溶于水;
B.加水,若图中甲、乙管形成液面差,则装置不漏气;
C.HCl与硅酸钠反应生成硅酸,可知酸性盐酸大于硅酸,但盐酸为无氧酸;
D.橡皮管可使下方压力转移到上部.
解答 解:A.NO不溶于水,则导管短进长出排出液体可收集NO,故A正确;
B.加水,若图中甲、乙管形成液面差,则装置不漏气,则用图示的方法能检査此装置的气密性,故B正确;
C.HCl与硅酸钠反应生成硅酸,可知酸性盐酸大于硅酸,但盐酸为无氧酸,不能比较Cl、Si的非金属性,故C错误;
D.橡皮管可使下方压力转移到上部,则橡皮管的作用是能使水顺利流下,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、气密性检验、气体的收集、非金属性比较为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲基丙酸乙酯的分子式是C6H12O2 | |
| B. | 用乙醇与NaOH的醇溶液共热消去制乙烯 | |
| C. | 分子式是C5H12O的醇共有8种(不考虑立体异构) | |
| D. |  中可能有6个碳原子在同一直线上 中可能有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4的沸点高于CH4,可推测PH3的沸点高于NH3 | |
| B. | C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子 | |
| C. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| D. | NH4+为正四面体结构,可推测PH4+也为正四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
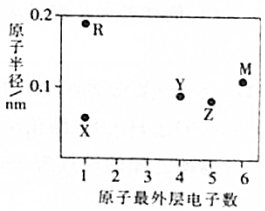 五种短周期主族元素X、Y、Z、M、R的原子半径和最外层电子数之间的关系如图所示,其中R的原子半径是短周期主族元素原子中最大的.下列说法正确的是( )
五种短周期主族元素X、Y、Z、M、R的原子半径和最外层电子数之间的关系如图所示,其中R的原子半径是短周期主族元素原子中最大的.下列说法正确的是( )| A. | 元素的非金属性:X>Z>Y | |
| B. | M的单质常温常压下为气态 | |
| C. | X和M形成的二元化合物的水溶液呈弱酸性 | |
| D. | Y、Z、M的最高价氧化物的水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢氧化钠溶液迅速倒入盛有盐酸的量热计中 | |
| B. | 浓硫酸加水稀释 | |
| C. | 氯化铵固体和氢氧化钡固体在烧杯中混合搅拌 | |
| D. | 甲烷的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,
在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  对甲基苯酚,属于芳香化合物 | B. |  3-甲基戊烷,属于烷烃 | ||
| C. |  2-甲基-1-丙醇,属于一元醇 | D. |  3-甲基-1-丁烯,属于脂肪烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com