
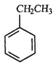
 (g)+CO2(g)?
(g)+CO2(g)?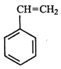 (g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行
(g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行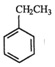 (g)?
(g)?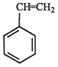 (g)+H2(g)△H1=-125KJ/mol
(g)+H2(g)△H1=-125KJ/mol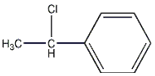 .
.
分析 (1)方程A+方程B,根据盖斯定律分析计算;
(2)苯乙烯与HCl加成的产物中具有手性异构体的分子即Cl加到H少的那个碳上;
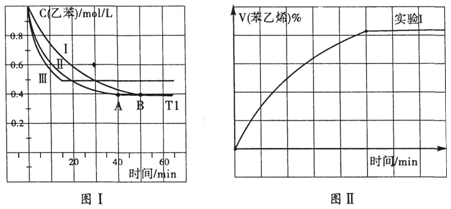
(3)①根据图I中乙苯的浓度变化,求出反应速率;
②根据图I中实验Ⅱ改变条件平衡不移动,反应速率增大;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小;
(4)pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,所得溶液pH=11,混合溶液呈碱性,溶液中c(OH-)=0.001mol/L,设溶液的体积为x、y,根据氢氧根离子、氢离子的物质的量及混合后溶液体积计算出混合溶液中c(OH-),再计算出溶液中氢离子浓度及溶液的pH即可;.
解答 解:(1)方程A+方程B得到: (g)+CO2(g)?
(g)+CO2(g)? (g)=CO(g)+H2O(g)△H,所以该反应的反应热为:△H=△H1+△H2=-125-41=-166KJ/mol,
(g)=CO(g)+H2O(g)△H,所以该反应的反应热为:△H=△H1+△H2=-125-41=-166KJ/mol,
故答案为:-166KJ/mol;
(2)苯乙烯与HCl加成的产物中具有手性异构体的分子即Cl加到H少的那个碳上,则结构简式为 ,故答案为:
,故答案为: ;
;
(3)①根据图I中可知,0-50min时乙苯的浓度变化为1.0mol/L-0.4mol/L=0.6mol/L,则其反应速率为v=$\frac{△c}{△t}$=$\frac{0.6mol/L}{50min}$=0.012mol/(L•min);
故答案为:0.012mol/(L•min);
②根据图I中实验Ⅱ改变条件平衡不移动,而反应速率增大,所以改变的条件是加催化剂,故答案为:加催化剂;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小,其图形为: ;
;
故答案为: ;
;
(4)pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,所得溶液pH=11,混合溶液呈碱性,溶液中c(OH-)=0.001mol/L,设酸溶液体积为x,碱溶液体积为y,则:$\frac{0.1mol/L×y-0.01×x}{x+y}$=0.001mol/L,解得y:x=1:9,即Va:Vb=1:9,
故答案为:1:9.
点评 本题综合性较大,涉及盖斯定律、手性碳原子的判断、反应速率的计算、平衡移动原理以及溶液pH的计算等,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol•L-1 | B. | 9mol•L-1 | C. | 11mol•L-1 | D. | 12mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.448 L | B. | 0.224L | C. | 0.336L | D. | 无法求解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘食盐不能使淀粉溶液变蓝 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应集中回收并填埋处理,开发废电池的综合利用技术 | |
| D. | 乙醇是不可再生的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | Na2CO3固体中含有的NaHCO3可用加热的方法除去 | |
| C. | Na2O2和Na2O均为白色固体,与CO2反应均放出O2 | |
| D. | 分别向Na2CO3和NaHCO3与澄清石灰水反应,现象不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3溶于过量NaOH溶液中:HSO3-+OH-═SO32-+H2O | |
| B. | 酸性KMnO4溶液与FeSO4溶液反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O | |
| C. | CaCO3溶于CH3COOH溶液中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 标准状况下足量Cl2通入100mL0.1 mol•L-1FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯化铝溶液加热蒸干灼烧可得到氧化铝 | |
| B. | 实验室通常使用热的纯碱溶液去除油污 | |
| C. | 铵态氮肥不宜与草木灰混合使用 | |
| D. | 用大理石与醋酸制取少量二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com