
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | P H=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
分析 (1)酸碱恰好完全反应,如反应后呈中性,则pH=7,为强酸,如pH>7,则为弱酸;
(2)若HA为强,则C等于0.2,若HA为弱酸,则C大于0.2,所以C不一定为0.2,结合电荷守恒判断;
(3)pH>7,所以HA是弱酸,得到的溶液为0.05mol/L的HA和0.05mol/L的NaH的混合液;
(4)所得混合溶液为浓度为0.05mol/L的NaA溶液,其pH为9,促进水的电离,OH-全部为水电离,以此可计算浓度.
解答 解:(1)不考虑其它组的实验结果,单从甲组情况分析,若a=7,则HA是强酸;若a>7,则HA是弱酸,
故答案为:若a=7,则HA是强酸;若a>7,则HA是弱酸;
(2)不考虑其它组的实验结果,单从乙组情况分析,pH=7,若HA为强酸,则C等于0.2,若HA为弱酸,则C大于0.2,所以C不一定为0.2,故答案为:否;
(3)HA物质的量浓度为0.2mol/L,而NaOH物质的量浓度为0.1mol/L,pH>7,所以HA是弱酸,丙组得到的溶液为0.05mol/L的HA和0.05mol/L的NaH的混合液,根据电荷守恒可以得到c(OH-)+c(A-)=c(Na+)+c(H+),由于pH>7,所以c(OH-)>c(H+),即c(Na+)>c(A-),所以混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+);
(4)丁组实验所得混合溶液为浓度为0.05mol/L的NaA溶液,其pH为9,促进水的电离,OH-全部为水电离,所以由水电离出的c(OH-)=10-5mol/L,
故答案为:10-5mol/L.
点评 本题考查较为综合,涉及了盐类水解、强弱酸、电荷守恒等知识,有一定的综合性,为高考常见题型,侧重于学生的分析能力和计算能力的考查,该题的命题方式为高考命题的热点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯离子的结构示意图: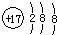 | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_6^{14}$C | |
| C. | 氯化镁的电子式: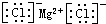 | |
| D. | 乙烯结构简式CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| B. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| C. | NO的摩尔质量为30g | |
| D. | 常温常压下32g臭氧中含有的氧原子数目比标准状况下22.4L氧气中含有的氧原子数目少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | C(CH3)4 | D. | CH3CH(CH3)CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com