
| A. | 氢氧化钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 在AlCl3溶液中加入过量氨水最终无沉淀生成 | |
| C. | 工业上可利用钠和TiCl4溶液反应制取金属Ti | |
| D. | 锅炉中水垢可用盐酸或醋酸除去 |
分析 A.氢氧化钠有腐蚀性;
B.氢氧化铝沉淀不溶于过量的氨水中;
C.在溶液中含有水,钠与水容易反应;
D.从水垢的主要成分碳酸钙和氢氧化镁可和盐酸或醋酸反应生成溶于水的物质去分析.
解答 解:A.氢氧化钠有腐蚀性,不能作抗酸药,故A错误;
B.向AlCl3溶液中加入过量的氨水,会生成氢氧化铝沉淀,该沉淀不溶于过量的氨水中,故B错误;
C.在溶液中含有水,钠与水容易反应,钠与TiCl4在高温下才能置换金属钛,故C错误;
D.水垢的主要成分碳酸钙和氢氧化镁可和盐酸或醋酸反应生成溶于水的物质,所以可用盐酸或醋酸除去水垢,故D正确.
故选D.
点评 本题考查物质的性质和沉淀转化等,难度不大,注意在溶液中含有水,钠与水容易反应.


科目:高中化学 来源: 题型:选择题
| A. | 采用加热分解法冶炼金属钾 | B. | 采用电解法冶炼金属铝和钠 | ||
| C. | 采用热还原法冶炼金属铁与汞 | D. | 采用热还原法冶炼金属铜与钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | A | B | C | D |
实验 装置 |  | 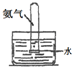 | 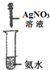 | 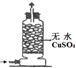 |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
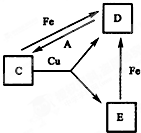 有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:
有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:Fe3+、Na+、SO42-、Cl- | |
| B. | b点对应的溶液中大量存在:Fe2+、Cl-、NO3-、Na+ | |
| C. | c点对应的溶液中大量存在:Ba2+、Cl-、Na+、Br- | |
| D. | d点对应的溶液中大量存在:Cu2+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
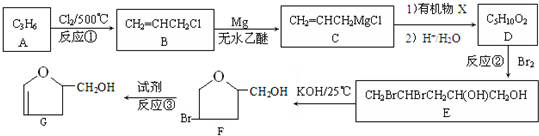
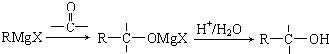
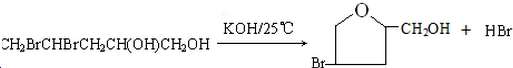 (或
(或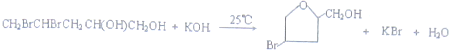 );;
);;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com