
【题目】某化学实验小组用下图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。
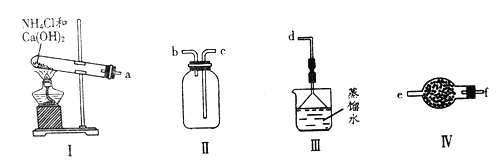
回答下列问题:
(1)写出利用装置I制取氨气的化学方程式_________________________________。
(2)按照气流方向,仪器连接的顺序:a→___________________________→d(用字母编号表示)。
(3)实验中装置III的作用________________。
(4)装置IV中仪器的名称为________,盛装的试剂为______________。
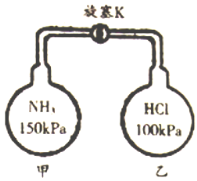
(5)在甲、乙玻璃容器中分别收集氨气和氯化氢,按下图装置进行实验。打开旋塞K,观察到的实验现象是_____________________________。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O febc 吸收尾气,防止污染 干燥管 碱石灰 乙瓶中出现白烟
CaCl2+2NH3↑+2H2O febc 吸收尾气,防止污染 干燥管 碱石灰 乙瓶中出现白烟
【解析】
(1)NH4Cl与Ca(OH)2加热时发生反应生成氯化钙、氨气和水;
(2)装置I为氨气发生装置;装置II为气体收集装置,装置III为尾气处理装置,装置Ⅳ为干燥装置,由此选择实验装置连接;
(3)氨气有刺激性气味,会污染大气,氨气极易溶于水,实验中装置III的作用吸收尾气,防止污染;
(4)根据常见仪器的名称解答IV中仪器的名称,氨气为碱性气体,通常用碱石灰进行干燥;
(5)根据甲、乙容器压强以及甲、乙混合后压强相等以及氨气和氯化氢反应生成氯化铵分析;氨气、氯化氢为气体,反应生成的氯化铵为固体。
(1)装置I中NH4Cl与Ca(OH)2加热时发生反应生成氯化钙、氨气和水,化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O ;
CaCl2+2NH3↑+2H2O ;
(2)利用装置I制取氨气,首先选a,制出的氨气中含有水蒸气,需进行干燥,选用装置Ⅳ,粗口进,细口出,所以选fe,根据氨气的密度小于空气的密度,选择收集装置及方法bc,氨气极易溶于水且属于大气污染气体,用防倒吸的装置进行尾气吸收选择d,所以连接顺序为afebcd;
(3)氨气有刺激性气味,会污染大气,氨气极易溶于水,1体积水可溶解700体积氨气,尾气吸收应防止倒吸的发生,实验中装置III的作用吸收尾气,防止污染;
(4)装置IV中仪器为干燥管,通常盛放固体干燥剂,氨气为碱性气体,通常用碱石灰进行干燥;
(5)甲容器压强为150kPa,乙容器压强100kPa,甲容器压强大于乙容器,先打开旋塞,甲容器中的氨气进入乙容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以乙瓶中出现白烟。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】湖北随州安陆等地区盛产银杏,银杏叶具有敛肺平喘、活血化淤、止痛的作用,是一种珍贵的中药材。对银杏叶活性成分黄酮类物质的提取常用的技术有溶剂提取法、蒸馏法、升华法、结晶法、超声波提取法等。下列关于分离提纯实验仪器和操作正确的是
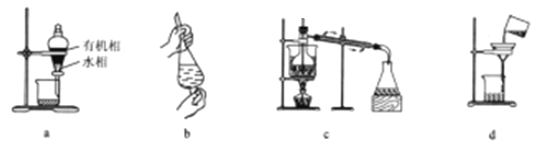
A. 用装置a分液,放出水相后再从分液漏斗下口放出有机相
B. 操作b:银杏油粗产品从银杏叶中分离后,用有机溶剂萃取其中的有效成分,振荡过程中不时地旋开活塞使漏斗内气体放出
C. 用装置c进行蒸馏操作,将有机溶剂分离出去得到银杏叶有效成分黄酮类物质
D. 结晶后利用装置d将晶体与溶剂分离开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氯的制备、应用等环节。回答下列问题:
(1)氢气的制备
以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。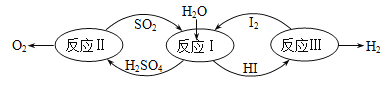
反应Ⅱ包含两步反应:
①H2SO4(1)=SO3(g)+H2O(g) ΔH=177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H=196kJ/mol
写出反应Ⅱ的热化学反应方程式__________
(2)氯气的应用
CO2加氢制备甲酸(HCOOH)可用于回收利用CO2。温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)![]() HCOOH(g) △H,化学平衡常数K=1
HCOOH(g) △H,化学平衡常数K=1
实验测得:v正=k正·c(CO2)·c(H2), v逆=k逆·c(HCOOH),k正、k逆为速率常数。
①当CO2的转化率为33.3%时,HCOOH的体积分数为_____(保留整数)。
②T1时,k逆=_________(用k正表示)。当升高温度至T2时,k逆=0.9k正,则△H____0(填“>”、“<"或“=”)。
③采用电还原法也可将CO2转化为甲酸根,用Sn为阴极、Pt为阳极,KHCO3溶液为电解液进行电解。CO2应通入______区(填“阳极”或“阴极”),其电极反应式为__________
④可用NaHCO3代替CO2作为碳源加氢制备甲酸。向反应器中加入NaHCO3水溶液、A1粉、Cu粉,在300℃下反应。NaHCO3用量一定时,Al、Cu的用量对碳转化量影响结果如图。由图可知,曲线d相对其它三条曲线碳转化量变化不大的主要原因是__________,当碳转化量为30%时所采用的实验条件是____________。
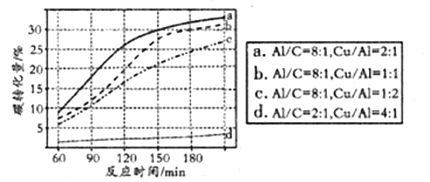 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①江河入海口三角洲的形成通常与胶体的性质有关
②“钡餐”中使用的硫酸钡是弱电解质
③冰和干冰既是纯净物又是化合物
④雾是气溶胶,在阳光下可观察到丁达尔现象
⑤某无色溶液中加入稀盐酸,产生的气体可使澄清石灰水变浑浊,则原溶液中一定含CO![]()
⑥可用渗析法分离Fe(OH)3胶体和KCl溶液
A. ①③④⑤ B. ①③④⑥ C. ①③④⑤⑥ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是____________(填写编号);
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)当产生0.1 mol Cl2时,转移电子的数目为_____________;
(3)ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以同质量的物质得到的电子数多少来衡量)是Cl2的______倍(结果小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
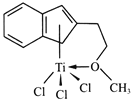
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
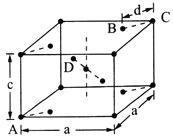
①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用足量的一氧化碳还原4.64 g某金属氧化物,把生成的二氧化碳全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此金属氧化物是下列中的( )
A. 氧化铜 B. 氧化铁 C. 四氧化三铁 D. 二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1mol/LNaOH溶液分别滴加到0.1mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,下列说法不正确的是
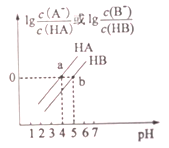
A. Ka(HB)<Ka(HA)
B. a点时,c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaA溶液的pH大于0.1mol/LNaB溶液的pH
D. 向HB溶液中加入NaOH溶液,混合溶液中c(B-)/c(HB)=10[pH-pKa(HB)](已知:pKa=-lgKa)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com