
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+H2O |


科目:高中化学 来源: 题型:
| A、绿色化学的核心是应用化学原理对环境污染进行治理 |
| B、氯气和氢氧化钠溶液和石灰乳得到的含氯化合物都具有漂白性 |
| C、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| D、对“地沟油”蒸馏可以获得汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、①②③⑨ | B、②⑥⑨⑩ |
| C、③④⑤⑥ | D、⑦⑧⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
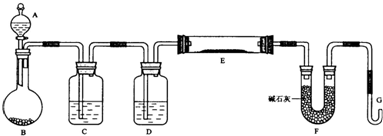
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾--淀粉试纸检验,观察试纸颜色的变化 |
| B、铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C、将SO2通入Ba(NO3)2溶液,有白色沉淀生成,证明BaSO3难溶于硝酸 |
| D、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
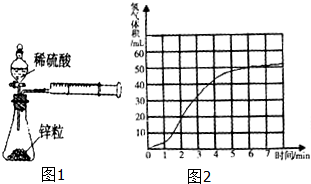 某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.
某课题组研究锌与稀硫酸的反应速率及影响因素,实验装置如图1所示.| 编号 | 反应速率表达式的定义 | 反应速率表达式 | 反应速率单位 | ||
| ① | 单位时间内Zn2+物质的量浓度的增加量 | v(Zn2+)=
| mol/(L?min) | ||
| ② |
| 编号 | 锌的形状 | 锌的规格 | 硫酸的浓度 | 反应温度 | 实验设计的目的 |
| ① | 块状 | 纯锌 | 1mol/L | 25℃ | Ⅰ.实验①和②研究 Ⅱ.实验②和③研究 Ⅲ.实验③和④研究 Ⅳ.实验④和⑤研究 |
| ② | 颗粒状 | 纯锌 | 1mol/L | 25℃ | |
| ③ | 颗粒状 | 纯锌 | 25℃ | ||
| ④ | 颗粒状 | 2mol/L | 25℃ | ||
| ⑤ | 颗粒状 | 粗锌 | 2mol/L | 35℃ | |
| … | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
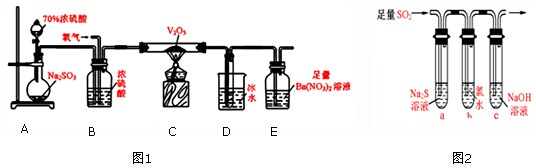
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com