
 我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.
我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.
| ||
| ||


科目:高中化学 来源: 题型:
| A、元素的原子序数 |
| B、元素原子的质子数 |
| C、元素原子的相对原子质量 |
| D、元素原子的中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).| n(CO2) |
| n(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
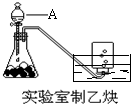 实验室制取乙炔的实验装置图(如图)中,
实验室制取乙炔的实验装置图(如图)中,查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 原子的最外层电子数是次外层电子数的3倍. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和. |
| E | 生产和生活中用量最大的金属. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②③ | B、只有③④ |
| C、只有①③ | D、只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 由图 可知:在密闭容器中进行反应A(g)+3B(g)?2C(g),虚线可表示使用了催化剂 |
B、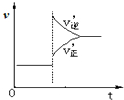 在密闭容器中进行反应A(g)+3B(g)?2C(g),若正反应的△H<0,如图可表示升高温度时反应速率的变化关系,也说明平衡逆向移动 |
C、 图表示将二氧化硫通入到一定量氯水中,通入的二氧化硫的体积与溶液pH的关系 |
D、 图表示用0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1 CH3COOH溶液所得到的滴定曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com