
| 物质 | 分子式 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水溶性 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
| A、萃取 | B、加热升华 |
| C、蒸馏 | D、分液 |
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 16m3 |
| m-m3 |
| 16m3 |
| m-m3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
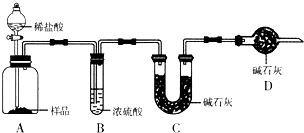 现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
|
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 | ① |
失败 | ② |
| 乙 | ③ |
成功 | ----- |
| 丙 | ④ |
成功 | ---- |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省烟台市高三3月诊断考试化学试卷(解析版) 题型:实验题
某化学小组采用下图装置模拟电解饱和食盐水制备氢气,通过氢气还原氧化铜测定Cu的相对原子质量,同时检验氯气的氧化性(图中夹持和加热仪器已经略去)。

(1)写出装置甲中反应的离子方程式 。为完成上述实验,正确的连按方式为a连接 ,b连接 (填字母)。
(2)①装置乙烧杯中液体的作用是 。A瓶内盛装的溶液最好是 (填字母)。
a.I-淀粉溶液 b.NaOH溶液
c.FeCl2与KSCN混合溶液 d.Na2SO3溶液
②加热装置丙中的氧化铜粉末之前,除了要检查该装置的气密性还需进行的必要操作是 。
(3)利用装置丙测定Cu的相对原子质量,现有两种方案:①测得反应前后洗气瓶B及其中液体质量差m1,②测得反应前后U形管及其中固体质量差m2。你认为合理的方案为 (填“①”或“②”)。若采用测得反应后硬质玻璃管中剩余固体的质量m3的方案,已知O的相对原子质量为16,实验中氧化铜样品质量为m,则测定Cu的相对原子质量的表达式为 ,该方案在反应后硬质玻璃管冷却过程中没有一直通氢气,会导致测定Cu韵相对原子质量 (填“偏大”、“偏小”或“无影响”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。为了进一步研究硫酸铜的量对氢气生成速率的影响,该小组同学开始了实验探究。
⑴实验方案:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的锥形瓶中,收集产生的气体。记录单位时间氢气产生的体积。
| 实验混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
其中:V1= ,V6= ,V9= ;
⑵实验装置:甲同学拟选用下列实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸就不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验最后,在读取测量实验中生成氢气的总体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
 ④ 乙同学认为可选用右图装置中的_____(填A或B)直接与锥形瓶的导管A相连用以测量氢气的体积,理由是 ;实验结束时量筒内的液面高于水槽中液面,立即读数会使氢气的总体积 (填“偏大”“偏小”或“不变”);应进行的操作是 ;
④ 乙同学认为可选用右图装置中的_____(填A或B)直接与锥形瓶的导管A相连用以测量氢气的体积,理由是 ;实验结束时量筒内的液面高于水槽中液面,立即读数会使氢气的总体积 (填“偏大”“偏小”或“不变”);应进行的操作是 ;
⑶实验现象与结论:反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;该学习小组最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
⑷问题讨论:实验室中现有![]() 、
、![]() 、
、![]() 、
、![]() 等4种溶液,可与实验中
等4种溶液,可与实验中![]() 溶液起相似作用的是 ;要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
溶液起相似作用的是 ;要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com