
(16分)(1)0.02mol/L的CH3COOH溶液与0.02mol/L CH3COONa溶液等体积混合,已知该混合溶液中,c(H+)>c(OH-),用“>、<、=”符号填空:
①溶液中c(Na+)_____c(CH3COO-) ② c(CH3COO-)_______ c(CH3COOH)
③ c(CH3COOH)+c(CH3COO-) 0.04 mol/L
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:
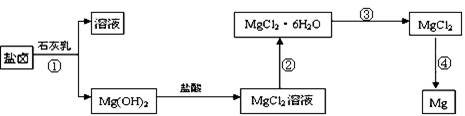
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)(1)0.02mol/L的CH3COOH溶液与0.02mol/LCH3COONa溶液等体积混合,已知该混合溶液中,c(H+)>c(OH-),用“>、<、=”符号填空:
①溶液中c(Na+)_____c(CH3COO-)② c(CH3COO-)_______ c(CH3COOH)
③ c(CH3COOH)+c(CH3COO-) 0.04 mol/L
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省养正中学、安溪一中高二上学期期末考试化学试卷 题型:填空题
(16分)(1)0.02mol/L的CH3COOH溶液与0.02mol/L CH3COONa溶液等体积混合,已知该混合溶液中,c(H+)>c(OH-),用“>、<、=”符号填空:
①溶液中c(Na+)_____c(CH3COO-) ② c(CH3COO-)_______ c(CH3COOH)
③ c(CH3COOH)+c(CH3COO-) 0.04 mol/L
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题: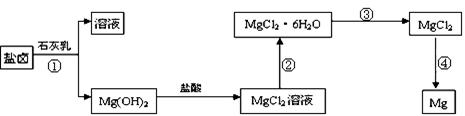
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二上学期期中考试化学试卷(解析版) 题型:选择题
可逆反应 N2(g)+3H2(g) 2NH3(g),在500℃时,将2molN2 和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
2NH3(g),在500℃时,将2molN2 和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
A. 0.01mol·L-1 B. 0.02mol·L-1
C. 0.05mol·L-1 D. 0.15mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com