
【题目】根据下列有关图象,说法正确的是
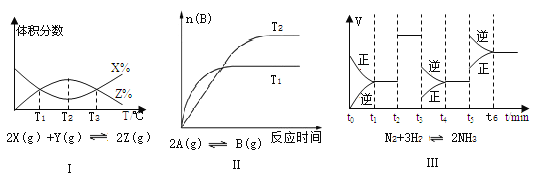
A. 由图Ⅰ知,该反应的△H>0 B. 由图Ⅱ知,该反应为放热反应
C. 由图Ⅲ知,t3时一定是采取降低反应温度的措施 D. 由图Ⅲ知,反应在t6时,NH3体积分数最大
【答案】B
【解析】
A.由图I可以看出,当温度低于T2时,随着温度升高,反应物X的体积分数逐渐减小,生成物Z的体积分数逐渐增大;当温度高于T2时,随着温度升高,反应物X的体积分数逐渐增大,生成物Z的体积分数逐渐减小。可推知T2条件下该反应已达到平衡状态,随后,升高温度平衡向逆反应方向移动,根据勒夏特列原理逆反应是吸热反应,故正反应是放热反应,所以该反应的△H<0。A项错误;
B.图II是生成物B分别在T1和T2条件下,其物质的量随时间的变化曲线,根据“先拐先平”的规律,T1温度下该反应先达到平衡,说明温度高低:T1>T2。由图II知平衡时B的物质的量大小关系:T1<T2,说明该反应由温度为T1降低到温度为T2时,平衡向正反应方向移动,根据勒夏特列原理正反应是放热反应,即该反应为放热反应,B项正确;
C.由图Ⅲ可知t3时正、逆反应都减小,且![]() ,说明t3时改变的条件使反应速率减小且平衡向逆反应方向移动,由反应式N2(g)+3H2(g)
,说明t3时改变的条件使反应速率减小且平衡向逆反应方向移动,由反应式N2(g)+3H2(g)![]() 2NH3(g)可知,t3时改变的条件也可以是减小压强,C项错误;
2NH3(g)可知,t3时改变的条件也可以是减小压强,C项错误;
D. 由图III可知,反应N2(g)+3H2(g)![]() 2NH3(g)在t1时第一次建立平衡,t2~t3时平衡没有移动,NH3的体积分数不变;t3~t4过程中平衡向逆反应方向移动,NH3的体积分数减小;t5~t6改变的条件使平衡向逆反应方向移动,NH3的体积分数进一步减小,所以达到平衡的各阶段中t6时NH3的体积分数最小,D项错误;答案选B。
2NH3(g)在t1时第一次建立平衡,t2~t3时平衡没有移动,NH3的体积分数不变;t3~t4过程中平衡向逆反应方向移动,NH3的体积分数减小;t5~t6改变的条件使平衡向逆反应方向移动,NH3的体积分数进一步减小,所以达到平衡的各阶段中t6时NH3的体积分数最小,D项错误;答案选B。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4 )2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。请回答下列问题:
(1)取少量(NH4)2Cr2O7浓溶液于试管中,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是______________。
(2)为探究(NH4)2Cr2O7 (摩尔质量为252 g/mol)加热的分解产物,按下图连接好仪器,加热装置略去,在A中加入5.040 g样品进行实验。
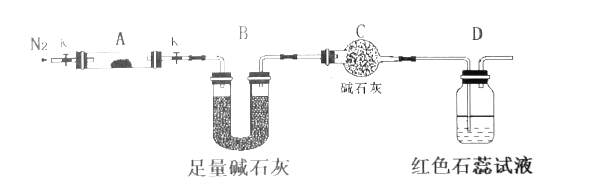
①仪器A的名称是______________。
②连接好装置,点燃酒精灯之前,先通入一段时间N2其目的为___________。
③反应结束后,依然要通一段时间的氮气的原因是________________________。
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44 g,写出重铬酸铵加热分解反应的化学方程式:____________________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mo1 (CH2)6N4H+ 与 1 mo1 H+ 相当],然后用 NaOH 标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600 g,配成500 mL溶液,移取25.00 mL样品溶液于 250 mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,摇匀、静置5 min后,加入12滴酚酞试液,用0.200 mo1 L-1 NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为16.00 mL。
①若滴定终点时,俯视读数,则测定结果_____(填“偏大” “偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O)
2KCl+2MnCl2+5Cl2↑+8H2O)

(1)e处反应的离子方程式为_________________________________________。该反应中氧化剂和还原剂的物质的量之比为_______________________。
(2) d处的实验现象:__________________________________________。
(3)c处反应的化学方程式为_________________________________。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为__________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?__________(填“能”或“不能” ),若能,其氧化性由强到弱的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:现有以下几种物质①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸钠、⑥亚硫酸氢钠、⑦氨水。请回答下列问题:
(1)以上物质属于弱电解质的是______________(填序号);
(2)常温下④的溶液pH_____7(填“>”“<”或“=”),原因__________(用离子方程式表示);
(3)⑥的水溶液中呈酸性,原因是__________________________;
(4)常温下,将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
(5)已知:a.常温下,醋酸和NH3H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈______性。
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。
II:25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
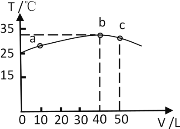
(7)由图可以推出HA溶液的物质的量浓度为_______________,25℃时,pH=3的HA溶液的电离度为______________。
(8)b点溶液中离子浓度由大到小的顺序为_______________________。
(9)加入NaOH溶液至溶液呈中性时出现在图中的位置_________(填“b点前” “b点”或“b点后”),溶液呈中性时,存在:c(A-)______c(Na+)(填“>”“<”或“=”)。
III:(10)已知:Ksp[Al(OH)3]=1×10-33, pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:

(1)A元素气态氢化物的电子式___,A、B、C、D四种元素按原子半径由大到小的顺序排列为___。(填元素符号)
(2)A的最高价氧化物与氢氧化钠反应的离子方程式为___。
(3)A,C,D的最高价氧化物对应水化物的酸性强弱_______,C的氢化物比D的氢化物沸点___(填“高”或“低”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既不能使溴水褪色,又不能使酸性高锰酸钾溶液褪色的是
①乙烷 ②乙烯 ③乙炔 ④苯 ⑤甲苯 ⑥溴乙烷 ⑦聚丙烯 ⑧环己烯
A. ①②③⑤ B. ①④⑥ C. ①④⑥⑦ D. ②③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
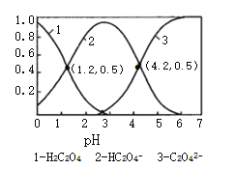
A. pH=1.2溶液中:c(K+)+c(H+)═c(OH﹣)+c(H2C2O4)
B. H2C2O4的第一步电离,平衡常数为10-1.2
C. 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学原理,完成下列各题
(1)从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应:N2(g)+ 3H2(g)![]() 2NH3(g) △H=﹣93kJ/mol。试根据表中所列键能数据,计算a 的数值为____kJ/mol。
2NH3(g) △H=﹣93kJ/mol。试根据表中所列键能数据,计算a 的数值为____kJ/mol。
化学键 | H﹣H | N﹣H | N≡N |
键能/(kJ/mol) | 436 | a | 945 |
(2)25 ℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
(3)向含有BaSO4的饱和溶液中
①加入Na2SO4溶液,则c(Ba2+)__________(填“变大”、“变小”或“不变”,下同)。
②若改加更多的固体BaSO4,则c(Ba2+)将__________。
(4)目前已开发出用电解法制取ClO2的新工艺。

①图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________。
②电解一段时间,当阴极产生的气体体积为112 mL (标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com