
| A. | 现向10mL浓度为0.1 mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度始终增大 | |
| B. | 保存Fe(NO3)2溶液时,应在其中加入稀HNO3以抑制Fe2+水解 | |
| C. | 将AlCl3溶液蒸干可得到固体AlCl3 | |
| D. | 向0.1 mol•L-1氨水中加入少量水,pH减小,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
分析 A.开始时,溶液的酸性逐渐减弱,水的电离程度逐渐增大,当氨水过量后,溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小;.
B.硝酸具有强氧化性能氧化亚铁离子;
C.AlCl3溶液在加热时水解生成Al(OH)3,Al(OH)3在加热条件下分解生成Al2O3;
D.氨水中一水合氨为弱电解质,溶液中存在电离平衡,加入少量水促进电离,氢氧根离子数增大,一水合氨分子数减小.
解答 解:A.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,故A错误;
B.保存Fe(NO3)2溶液时,若加入硝酸,会氧化亚铁离子为铁离子而变质,不能加入稀HNO3以抑制Fe2+水解,故B错误;
C.AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3,故C错误;
D.氨水溶液中存在电离平衡,加入少量水促进电离,氢氧根离子数增大,一水合氨分子数减小,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$比值增大,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡影响因素分析、盐类水解的原理应用、氧化还原反应实质理解,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

 ;
; ;
; .
. .
. .
. 和
和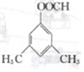 .
. . 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体
. 仿照上述流程,设计以苯、乙醛为有机原料(无机试剂任选)制备某药物中间体 的合成路线:
的合成路线: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| A(g) | B(g) | C(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的正反应为△H<0 | |
| B. | 207℃,K=4 | |
| C. | 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同 | |
| D. | 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Mg(s)+CO2(g)→2MgO(s)+C(s) | |
| B. | 低温下能自发进行的反应:NH3(g)+HCl(g)→NH4Cl(s) | |
| C. | 高温下能自发进行的反应:SiO2(s)+2C(s)→Si(s)+2CO(g) | |
| D. | 任何温度下均能自发进行的反应:2H2O2(l)→2H2O(l)+O2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| B. | 铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ | |
| D. | HCO3-水解:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com