
����Ŀ����ͼΪԪ�����ڱ���һ���֣�����բ�-���ڱ��е�λ�ã��ش��������⣺(��Ԫ�ط��Ż�ѧ����ش�)

(1)�ɢ٢ڢ�����Ԫ���γɵij���������ĵ���ʽΪ_____��������Ļ�ѧ������Ϊ_____(����Ӽ����������ۼ���)��
(2)�ߺ͢�����ԭ�Ӹ���1:2�γɻ�����õ���ʽ��ʾ���γɹ���______________��
(3)�ۢܢ�����Ԫ�طֱ��γɵļ����ӣ����Ӱ뾶�ɴ�С��˳����____________��
(4)�۵ļ��⻯��ķе�Ȣߵļ��⻯��ķе�___(��ߡ��͡�)������_____________��
(5)Ԫ�آĵ��ʺܵ͢�����������ˮ����֮�䷢����Ӧ�����ӷ���ʽΪ��____________��
���𰸡� ![]() ���Ӽ������ۼ�
���Ӽ������ۼ� ![]() O2-��Na+��Mg2+ �� ˮ���Ӽ��γ���� 2Al+2OH-+2H2O=2AlO2-+3H2��
O2-��Na+��Mg2+ �� ˮ���Ӽ��γ���� 2Al+2OH-+2H2O=2AlO2-+3H2��
�����������ȸ���Ԫ�������ڱ��е����λ���жϳ�Ԫ�����ƣ�Ȼ����Ԫ�������ɽ��
����Ԫ�������ڱ��е����λ�ÿ�֪�١���ֱ���H��N��O��Na��Mg��Al��S��Cl��K����
(1)�ɢ٢ڢ�����Ԫ���γɵij������������Ȼ�泥��������Ӽ����ۼ������ӻ��������ʽΪ![]() ��
��
(2)�ߺ͢�����ԭ�Ӹ���1:2�γɻ�������K2S���������Ӽ������ӻ�����õ���ʽ��ʾ���γɹ���Ϊ![]() ��
��
(3)��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С����ۢܢ�����Ԫ�طֱ��γɵļ������ɴ�С��˳����O2-��Na+��Mg2+��
(4)����ˮ���Ӽ��γ���������ˮ�ķе��������ķе㣻
(5)Ԫ�آĵ������ܵ͢�����������ˮ������������֮�䷢����Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2����


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£���Ӧ����һ���ܴ���������ǣ�������
A.��0.1mol/LNaHCO3��Һ�У�Al3+��NH4+��SO42����NO3��
B.�����£� ![]() =0.1mol/L����Һ�У�K+ �� Cl�� �� Fe2+ �� NO3��
=0.1mol/L����Һ�У�K+ �� Cl�� �� Fe2+ �� NO3��
C.ʹ���ȱ�����Һ�У�NH4+ �� Cl�� �� SO2�� �� Mg2+
D.25��ʱ��ˮ�������c��H+��=1��10��13mol/L��K+ �� Ba2+ �� NO3�� �� S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ��ͨ����������������ͬʱ�õ������ԭ����ͼ��ʾ��ͼ��HA��ʾ������ӣ�A����ʾ��������ӣ�������˵����ȷ���ǣ� ��
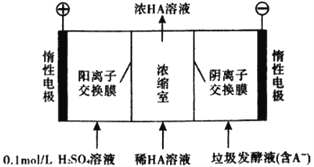
A. ͨ�����������pH����
B. ���ӴӸ������������Һ�ص�����
C. ͨ���A��ͨ�������ӽ���Ĥ����������Ũ����
D. ����·��ͨ��2 mol���ӵĵ���ʱ������1 mol��O2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��YΪ����Ԫ�ص�ԭ����X����������Y�������Ӿ�����ͬ�ĵ��Ӳ�ṹ���ɴ˿�֪ (����)
A. X��ԭ�Ӱ뾶����Y��ԭ�Ӱ뾶
B. X�ĵ縺��С��Y�ĵ縺��
C. X����������Y��������
D. X�ĵ�һ�����ܴ���Y�ĵ�һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���ԭ���ķ����Ǵ��ܺ��ܼ����ľ�������ǻ�ѧ����������ش��ס�
(1)ij����ʵ��С����̽������ͭ�Ľ�����(ԭ��ʧ��������)ǿ����ͬѧ�����������ʵ�鷽����
A.�Ƚ�����ͭ��Ӳ�Ⱥ��۵�
B.�Ƚ϶�����ϡ�����еı���
C.����Ƭ��ͭƬ����������Һ������ͭ��Һ���Ƚ϶��ߵĻ��
D.�ֱ�����Ƭ��ͭƬ��NaOH��Һ��Ӧ��ʵ��
E.����Ƭ��ͭƬ�õ������Ӻ�ͬͶ��ϡ�����н�������ƣ��۲��������
�����������ܴﵽʵ��Ŀ�ĵ���_____________��
(2)��������������Ӧ��A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2����������Ӧ������Ƴ�ԭ��ص���__________(����ĸ����)�������������ʷ�����___��Ӧ(����������������ԭ��)��
(3)����пƬ�ʹ�ͭƬ����ͼ��ʾ��ʽ����100mL��ͬŨ�ȵ�ϡ����һ��ʱ�䣬�ش��������⣺

������˵����ȷ����________(����ĸ����)��
A.�ס��Ҿ�Ϊ��ѧ��ת��Ϊ���ܵ�װ�� B.����ͭƬ��û�����Ա仯
C.����ͭƬ�������١�����пƬ�������� D.���ձ�����Һ��pH������
������ͬʱ���ڣ����ձ��в������ݵ��ٶȣ���___��(����>������<������=��)��ԭ����______��
�������в���1.12L(��״��)����ʱ����п��ͭƬȡ�����ٽ��ձ��е���Һϡ����1L�������Һ��c(H+)=0.1mol/L(�跴Ӧǰ����Һ�������)����ȷ��ԭϡ��������ʵ���Ũ��Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ���ǣ�������
A.������������������Ƿֱ���ȫȼ�գ����߷ų�������һ����
B.������ȼ����Ϊ285.8kJ/mol��������ȼ�յ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g���T2H2O��l����H=��285.8 kJ/mol
C.2H2��g��+O2��g���T2H2O��l����H=��Q1 kJ/mol 2H2��g��+O2��g���T2H2O��g����H=��Q2 kJ/mol����Q1��Q2
D.��֪�к���Ϊ57.3 kJ/mol��������0.5molH2SO4��Ũ��Һ�뺬1molNaOH����Һ��ϣ��ų�����������57.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ����������222 86Rn��˵����ȷ���� ( )
A. ������Ϊ222 B. ������Ϊ86
C. ������Ϊ136 D. �˵����Ϊ222
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д����̬��ԭ�ӵĵ����Ų�ʽ______.����ͬ���ڵĻ�̬ԭ�ӵ�M �����ȫ������Ԫ��λ�����ڱ���_____��; ��̬ԭ�ӱ�ɼ���̬ԭ�Ӳ����Ĺ���_________���ס�
��2����ͪ( )������2��̼ԭ�ӵ��ӻ���ʽΪ____________;��CS2��Ϊ�ȵ��������������____(дһ��);CO32-�����幹����________��
)������2��̼ԭ�ӵ��ӻ���ʽΪ____________;��CS2��Ϊ�ȵ��������������____(дһ��);CO32-�����幹����________��
��3����0.1mol[Cr(H2O)Cl]Cl2��H2O��ˮ��Һ��������������Һ��Ӧ����_____mol AgCl������H2O���ӵļ��DZ�H2S���ӵļ��Ǵ�,ԭ����_________��
��4����ͼ��ʾΪGaAs�ľ����ṹ��

��һ����ԭ����Χ���о����������ȵ���ԭ���γɵĿռ乹����______
����֪�����ⳤa=5.64��10-10m.��þ����ܶ�Ϊ��=_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com