
| A. | pH=11 | B. | pH=10.3 | ||
| C. | c(H+)=2×10-12 mol•L-1 | D. | c(H+)=(10-12+10-10)/2 mol•L-1 |
分析 计算不同pH的NaOH溶液中氢氧根离子浓度,再计算混合后氢氧根离子浓度,根据Kw=c(H+)×c(OH-)=10-14,计算混合溶液中c(H+),溶液pH=-lgc(H+).
解答 解:pH=12的NaOH溶液中c(OH-)=10-2mol/L,pH=10的NaOH溶液中c(OH-)=10-4mol/L,二者等体积混合后溶液的c(OH-)=$\frac{1}{2}$×(10-2+10-4)mol/L≈$\frac{1}{2}$×10-2mol/L,则混合溶液中c(H+)=$\frac{1{0}^{-14}}{\frac{1}{2}×1{0}^{-2}}$mol/L=2×10-12 mol•L-1,溶液pH=-lgc(H+)=2×10-12=11.7,
故选:C.
点评 本题考查pH简单计算,强酸(或强碱)等体积混合,若pH之和为14,混合后溶液呈中性,若pH<14,溶液呈酸性,pH混=pH小+0.3,若pH>14,溶液呈碱性,pH混=pH大-0.3,一般强酸(或强碱)pH相差至少2个单位.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓度为0.1 mol/L CH3COOH与0.1 mol/L CH3COONa混合后溶液呈弱酸性,则c(CH3COOH>c(Na+)>c(CH3COO-) | |
| B. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ | |
| C. | NaHCO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3) | |
| D. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | Mg原子结构示意图: | |
| D. | 硫酸铁的电离方程式 Fe2(SO4)3=2Fe3++3SO42ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3>I->Fe2+>NO | B. | I->Fe2+>H2SO3>NO | ||
| C. | Fe2+>I->H2SO3>NO | D. | NO>Fe2+>H2SO3>I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物和生成物均为分子晶体 | |
| B. | 反应物和生成物都为直线型分子 | |
| C. | 反应时旧键断裂放出能量,新键形成吸收能量 | |
| D. | 产物中CO2的键能大于H2O,所以沸点高于H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- | |
| B. | 能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- | |
| C. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| D. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ④①②③⑤ | C. | ②③①④⑤ | D. | ①④②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
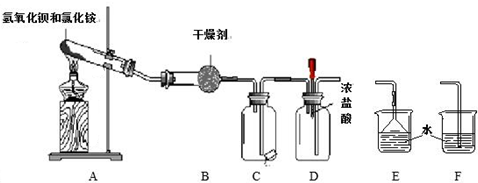
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com