
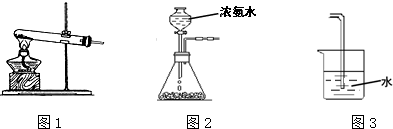
| 催化剂 |
| 高温高压 |
| N≡N | H-H | N-H | |
| 键能/kJ?mol-1 | 945 | 436 | 391 |
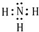 ,
, ;
;
| ||
| ||
| ||
| 280~450℃ |
| ||
| 280~450℃ |


科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| B、稀H2SO4与铁粉反应:Fe+4H+=Fe3++2H2↑ |
| C、氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ |
| D、三氧化二铁与稀盐酸混合:Fe2O3+6H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗 |
| B、酸式滴定管用蒸馏水洗后,用标准盐酸润洗 |
| C、滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失 |
| D、配置NaOH溶液时,NaOH固体中混有少量KOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热水瓶胆中的水垢可以用食醋除去 |
| B、可以用淀粉溶液检验加碘盐中是否含碘元素 |
| C、在蔗糖中加入浓硫酸出现黑色物质,说明浓硫酸具有脱水性 |
| D、做红烧鱼时,常加一些食醋和酒会更香,是因为生成少量的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca2++2ClO-=CaCO3↓+2HClO |
| B、将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-=CO32-+H2O |
| C、Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| D、向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
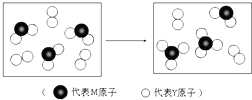
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com