
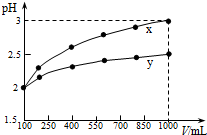
| A. | x为强酸,y为弱酸 | |
| B. | 稀释前x、y的物质的量浓度相等 | |
| C. | 随着稀释的进行,y的电离程度减小 | |
| D. | 等体积的x、y分别与足量的锌反应,y放出的氢气多 |
分析 加水至1000mL时,x的pH=3,说明x为强酸,而y的pH小于3,应为弱酸,结合弱电解质的平衡移动的特点解答该题.
解答 解:加水至1000mL时,x的pH=3,说明x为强酸,而y的pH小于3,应为弱酸,
A.由以上分析可知x为强酸,y为弱酸,故A正确;
B.稀释前pH相等,但y为弱酸,浓度应大于x,故B错误;
C.y为弱酸,加水稀释促进电离,电离程度增大,故C错误;
D.等体积的x、y,y的物质的量多,与足量锌反应时,y生成氢气多,故D正确.
故选AD.
点评 本体考查弱电解质的电离,题目难度不大,本题注意根据酸的稀释图象判断酸性的强弱为解答该题的关键,注意把握弱电解质的电离特点以及平衡移动的影响因素.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定时,用浓硫酸代替盐酸与NaOH溶液反应 | |
| B. | 用25mL碱式滴定管准确量取25.00mLKMnO4 标准溶液 | |
| C. | 用玻璃棒蘸取0.10 mol•L-1CH3COOH溶液点在用水湿润的广泛pH试纸上,测定该溶液的pH=3.2 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
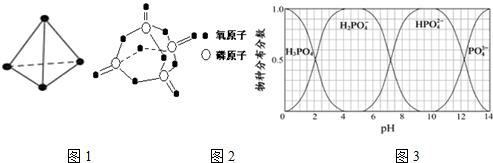
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质水解的最终产物均为氨基酸 | |
| B. | 油脂水解得到的醇是丙三醇 | |
| C. | 淀粉、纤维素、蛋白质和油脂都属于高分子化合物 | |
| D. | 淀粉、纤维素水解的产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com