
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
| A、浓氨水可检验氯气管道泄漏 |
| B、明矾可用作除去污水中悬浮颗粒的絮凝剂 |
| C、Si和SiO2都用于制造光导纤维 |
| D、硬铝、青铜和不锈钢都属合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
(1)某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.| 实验编号 | 待测HCl溶液的体积(mL) | 滴入NaOH溶液的体积(mL) |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
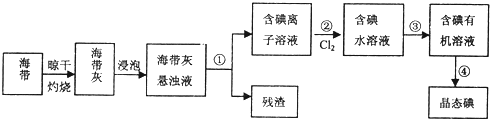
查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
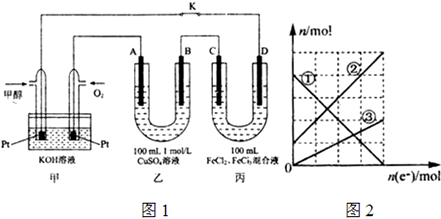
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是: H++NO2-=HNO2, 2HNO2=NO↑+NO2↑+H2O |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 |
| D | 向1mL1.0mol?L-1AlCl3溶液中滴加2mL10% NH4F溶液,再滴加1mL 3.0mol?L-1NH3?H2O溶液,无沉淀生成. | Al3+更易与F-结合成AlF63- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ |
| B、①④等体积混合后,溶液显碱性 |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com