
 氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:
氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题: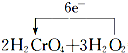 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.分析 (1)离子反应是由离子参加的反应,化合物在一定的条件下电离出能反应的离子;
(2)根据图象可知阴影部分为不属于置换反应的颐和花园,据此写出化学方程式;
(3)①可表示铁与硫酸铜、氯化铜的反应;
②可表示氢氧化钡与硫酸、硫酸氢钠的反应;
③只能表示氯气与水的反应;
④可表示碳酸钠、碳酸钾与盐酸、硝酸的反应;
⑤可表示硝酸银与盐酸、氯化钠的反应.
(4)①由失去电子的元素指向得到电子的元素,并标出电子转移的总数来用单线桥法标出电子转移的方向和数目;
②由反应可知生成3mol气体转移6mol电子,以此来计算.
解答 解:(1)离子反应是由离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,则必须是电解质发生电离,
故答案为:③⑤;
(2)根据图象可知阴影部分为不属于置换反应的颐和花园,符合条件的反应有:Fe2O3+3CO$\frac{\underline{\;加热\;}}{\;}$2Fe+3CO2,故答案为:Fe2O3+3CO$\frac{\underline{\;加热\;}}{\;}$2Fe+3CO2;
(3)①可表示铁与可溶性铜盐的反应,可表示一类反应,故①不选;
②可表示氢氧化钡与硫酸、硫酸氢钠的反应,可表示一类反应,②不选;
③只能表示氯气与水的反应,故③选;
④可表示可溶性碳酸盐与强酸的反应,可表示一类反应,故④不选;
⑤可表示硝酸银与盐酸、可溶性氯化物的反应,可表示一类反应,故⑤不选;
故选:③;
(4)①该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6-3)=6mol,则用单线桥法标出电子转移的方向和数目为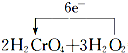 =2Cr(OH)3↓+3O2↑+2H2O,
=2Cr(OH)3↓+3O2↑+2H2O,
故答案为: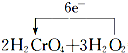 =2Cr(OH)3↓+3O2↑+2H2O;
=2Cr(OH)3↓+3O2↑+2H2O;
②由2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为$\frac{0.3}{6}$mol=0.15mol,
其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L.
点评 本题考查氧化还原反应,明确过氧化氢发生的反应及氧化还原反应中既有元素的化合价升高又有元素的化合价降低来分析是解答的关键,然后利用化合价变化来计算电子的转移即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 2:2:1 | C. | 8:16:15 | D. | 2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液 c(H+):①<② | |
| B. | 常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:c(Na+)=c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-) | |
| C. | 相同条件下,pH=9的①CH3COONa溶液、②NH3•H2O溶液、③NaOH溶液中由水电离出的c(OH-):①>②>③ | |
| D. | 已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 | |
| B. | 将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 | |
| C. | 向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl溶解度比Ag2S大 | |
| D. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水鉴别Al3+和Mg2+ | |
| B. | 用澄清石灰水鉴别SO2和 CO2 | |
| C. | 用稀H2SO4与Zn 反应制备H2 | |
| D. | 加热蒸干氯化铜溶液得到氯化铜晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com