
常温下,浓度均为0.1 mol•L-1的4种钠盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中不正确的是
A.四种溶液中,Na2CO3溶液中水的电离程度最大
B.向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度
C.NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32-
D.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:2015-2016学年江苏省高二上第二次质检化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.16gCH4所含原子数目为NA
B.1mol/LNaCl溶液含有NA个Na+
C.常温常压下,22.4LCO2中含有NA个CO2
D.2.4gMg与足量盐酸反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z+与Y2-具有相同的电子层结构,W与Y同族。下列说法正确的是( )
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Z在周期表中的位置为第3周期、IB族
C.W比Y更容易与氢气反应
D.X的最高价氧化物对应水化物的酸性比W的弱
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第五次月考化学试卷(解析版) 题型:选择题
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿的空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X.这四种金属的活动性顺序是
A.Y>Z>W>X B.Z>Y>W>X C.W>Z>Y>X D.X>Y>Z>W
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高级中学高三上第二次月考理综化学试卷(解析版) 题型:选择题
一块11.0g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2到溶液中无Fe3+存在,加热除去多余的H2O2,当加入200mL 6mol•L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3g,下列说法不正确的是
B.合金与稀硫酸反应共生成0.45mol H2
A.该合金中铁的质量为5.6g
C.该合金与足量氢氧化钠反应,转移的电子数为0.6NA
D.所加的稀硫酸中含0.6molH2SO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:实验题
Ⅰ:用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)如果按图中所示的装置进行试验,求得的中和热数值 (填“偏大、偏小、无影响”)。(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与
(2)中实验相比,所求中和热_________ (填“相等”或“不相等”)。
Ⅱ: (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。已知:C3H8(g) === CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH3CH=CH2(g)=== CH4(g)+ HC≡CH(g ) △H2=+32.4 kJ·mol-1
则C3H8(g) === CH3CH=CH2(g)+H2(g) △H = kJ·mol-1。
(2)发射火箭时用肼( )作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知 完全发生上述反应放出
完全发生上述反应放出 的热量,热化学方程式是: 。
的热量,热化学方程式是: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
以下是精确配制一定物质的量浓度NaOH溶液的实验步骤,其中操作正确的有( )

A.1步 B.2步 C.3步 D.4步
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上期中测试化学试卷(解析版) 题型:填空题
(1)在一定条件,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
①若A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向______(填“正”或“逆”)反应方向移动。
②若A、B、C均为气体,且m+n<p,加热后,可使混合气体平均摩尔质量增加,则正反应是______(填“吸热”或“放热”)反应。
③若在反应过程中,C的物质的量n(C)随时间的变化关系如右图所示(从t1时间开始对反应体系升高温度)。则a、b两点的正反应速率:v(a)______v(b)(填“>”、“<”或“=”);
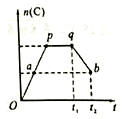
(2)Na2CO3溶液呈碱性,其原因是(用离子方程式表示)___________________;由同浓度的Na2CO3和NaHCO3组成的混合溶液中离子浓度由大到小的顺序为____________________;
(3)某温度下,纯水的c(H+)=3×10-7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH-)的比值为_________________;
(4)下列事实一定能说明HF是弱酸的是__________;
①常温下NaF溶液的pH大于7 ②常温下0.1mol/L的HF溶液pH=2.3
③HF能与Na2CO3溶液反应,产生CO2气体 ④1mol/L的HF水溶液能使紫色石蕊试液变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com