
| A. | ①② | B. | ③④ | C. | ①③ | D. | ①②③ |
分析 能发生酯化反应,有机物中应含有-OH或-COOH,又能发生加成反应,有机物中应含有C=C或-CHO,且能和新制的Cu(OH)2反应,应含有-CHO或-COOH,以此进行解答.
解答 解:①CH2=CHCH2OH含有C=C,可发生加成反应,含有-OH,可发生酯化反应,但不能和新制的Cu(OH)2反应,故①错误;
②CH3CH2CH2OH只含有-OH,只能发生酯化反应,不能发生加成,不能能和新制的Cu(OH)2反应,故②错误;
③CH2=CHCOOH含有C=C,可发生加成反应,含有-COOH,可发生酯化反应,能和新制的Cu(OH)2发生中和反应,故③正确;
④葡萄糖含有-OH,可发生酯化反应,含有-CHO,可发生加成,和新制的Cu(OH)2发生氧化反应,故④正确.
故选B.
点评 本题考查有机物的结构和性质,题目难度不大,注意根据官能团的性质判断有机物可能具有的性质.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6.4 g O2和O3的混合气体中含有的分子数为0.4NA | |
| B. | 0.1 mol Fe与少量氯气反应生成FeCl2,转移电子数为0.2 NA | |
| C. | 1.4 g由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3 NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
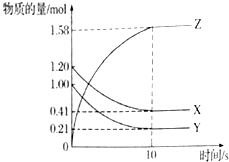 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,试回答下列问题:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
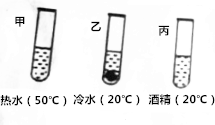 根据溶液有关知识,回答下列问题:
根据溶液有关知识,回答下列问题:| 温度/℃ | 10 | 30 | 50 | 70 | |
| 溶解度/g | NaCl | 35.8 | 36.3 | 37.0 | 37.8 |
| KNO3 | 20.9 | 45.8 | 85.5 | 138 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在液氨中加入NaNH2可使液氨的离子积变大 | |
| B. | 在液氨中加入NH4Cl可使液氨的离子积减小 | |
| C. | 在此温度下液氨的离子积为1×10-17 | |
| D. | 在液氨中放入金属钠,可生成NaNH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
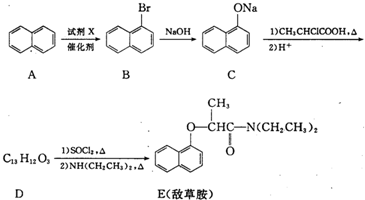
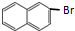 ,试剂X是液溴.
,试剂X是液溴.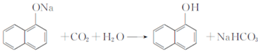 .
.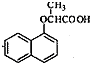 ,由D到E的过程中发生的化学反应类为取代反应.
,由D到E的过程中发生的化学反应类为取代反应.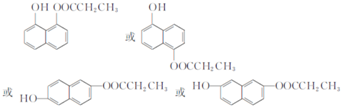 .
.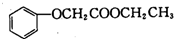 的合成路线图(无机试剂任用).合成路线图示例:
的合成路线图(无机试剂任用).合成路线图示例:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
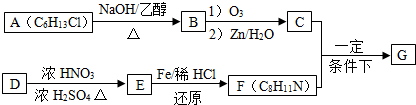
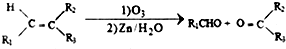

 .
.

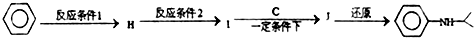
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com