
| A. | 加入过量浓盐酸:H+、Ba2+、Cl-、ClO- | |
| B. | 加入过量NaHCO3稀溶液:Na+、HCO3-、CO32-、C1O- | |
| C. | 加入过量 Fe(NO3)2溶液:Ba2+、NO3-、Fe2+、C1O- | |
| D. | 加入过量 Na2SO4溶液:Ba+、ClO-、Na+、SO42- |
分析 A.氢离子与次氯酸根离子反应生成次氯酸;
B.四种离子之间不反应,都不与碳酸氢根离子反应;
C.次氯酸根离子具有氧化性,能够氧化亚铁离子;
D.钡离子与硫酸根离子反应生成硫酸钡沉淀.
解答 解:A.H+、ClO-之间反应生成HClO,在溶液中不能大量共存,故A错误;
B.Na+、HCO3-、CO32-、C1O-之间不反应,在溶液中能够大量共存,故B正确;
C.Fe2+、C1O-之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Ba+、SO42-之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-?CH3COO-+H2O | B. | S2-+2H2O?H2S+2OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | CO32-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
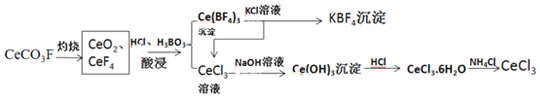
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将FeCl3饱和溶液滴入一定量的沸水中红褐色透明液体,用激光笔照射 | 有丁达尔效应 | 红褐色液体为胶体 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰为黄色 | 原溶液中有Na+、无K+ |
| C | 将气体X分别通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| D | 向溶液Y中滴加硝酸,再滴加BaCl2溶液 | 有白色沉淀生成 | Y中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
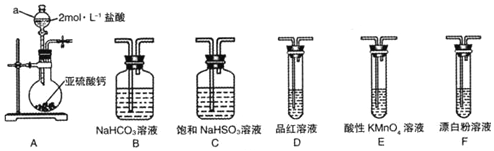
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀. | 淀粉己完全水解 |
| B | 向浓度均为0.1mol•L-1的Na2CO3和Na2S的混合溶液中,滴入少量AgNO3溶液,先产生黑色沉淀(Ag2S). | Ksp(Ag2S)<Ksp(Ag2CO3) |
| C | 向溶液X中先滴加稀硝酸,再滴加BaCl2溶液,出现白色沉淀. | 溶液X中一定含有SO42- |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色. | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将水沿器壁慢慢注入酸中 | |
| B. | 点燃氢气前,先检验氢气的纯度 | |
| C. | 加热液体时,试管口不对着人 | |
| D. | 利用丁达尔效应区别胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
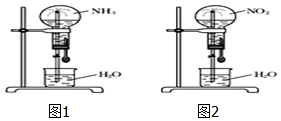 标准状况下,两个等体积的干燥圆底烧瓶中分别充满:①NH3②NO2,进行喷泉实验.下列说法正确的是( )
标准状况下,两个等体积的干燥圆底烧瓶中分别充满:①NH3②NO2,进行喷泉实验.下列说法正确的是( )| A. | 最终液体均能充满烧瓶 | |
| B. | 若在烧杯中的水中滴加酚酞,均能看到美丽的红色喷泉 | |
| C. | 实验结束后,烧瓶中的溶液的浓度均约为0.045mol/L | |
| D. | 喷泉的原理均是气体极易溶于水,使烧瓶内的压强减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠 | B. | 盐酸 | C. | 水煤气 | D. | 氯化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com