
| 1 |
| 3 |
| A、原子半径:rW>rZ>rY |
| B、Y形成的离子与W形成的离子的电子数不可能相同 |
| C、化合物X2Y、ZY、WY3中化学键的类型相同 |
| D、由X、Y、Z、W组成的化合物的水溶液可能显酸性 |
| 1 |
| 3 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
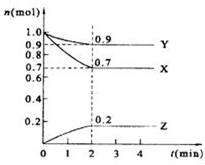 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:D>B>C>A |
| B、元素A、B的氧化物所含化学键的类型完全相同 |
| C、元素B和C的最高价氧化物对应水化物的碱性:B<C |
| D、元素B、C、D的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂 |
| B、向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解 |
| C、pH都为3的酸HA和HB分别与足量Mg反应,HA放出的H2多,说明酸性HA<HB |
| D、淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经开始水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 CH3COONa溶液中:c(OH-)>c(CH3COOH)+c(H+) |
| B、0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合后溶液显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| C、酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
| D、1.0L 0.3mol?L-1 NaOH溶液缓慢通入CO2气体至溶液增重8.8g,所得溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:rX>rY>rW>rQ |
| B、X、Y的最高价氧化物的水化物之间不能发生反应 |
| C、元素Q和Z能形成QZ2型的共价化合物 |
| D、Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、雌二醇和睾丸素两种物质的分子组成相差一个CH2,但不属于同系物 |
B、按系统命名法,有机物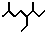 可命名为2,6-二甲基-4-乙基辛烷 可命名为2,6-二甲基-4-乙基辛烷 |
| C、氯气与甲烷在光照射的取代反应历程为:光照下,甲烷分子失去一个氢原子和甲基,甲基再与Cl2碰撞生成CH3Cl和氯自由基(Cl?) |
D、瘦肉精学名克伦特罗,结构如图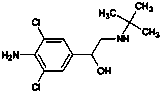 ,可以发生取代、加成、水解、酯化、消去反应 ,可以发生取代、加成、水解、酯化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 | ||
B、
| ||
| C、c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | ||
| D、c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
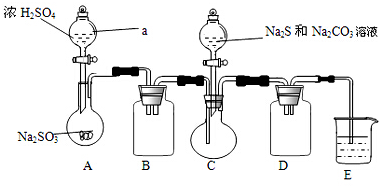
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com