
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN3的质量分数。实验步骤如下:
①称取约2.5000g叠氮化钠试样,配成250mL溶液。
②准确量取25.00mL溶液置于锥形瓶中,用滴定管加入50.00mL 0.1000mol·L-1
(NH4)2Ce(NO3)6(六硝酸铈铵),
[发生反应为:2(NH4)2Ce(NO3)6 +2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5mL浓硫酸,滴入2滴邻菲哕啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+= Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有 、 。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为 。
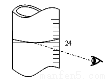
(3)若其它读数正确,滴定到终点后,读取滴定管中 (NH4)2Fe(SO4)2标准溶液体积按图图示读取,将导致所测定样品中叠氮化钠质量分数 (选填:“偏大”、“偏小”或“不变”)。
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)。
(1)250mL容量瓶、胶头滴管(每空1分,共2分)
(2)2NaN3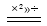 2Na + 3N2↑(2分)
2Na + 3N2↑(2分)
(3)偏小(2分)
(4)n[(NH4)2Ce(NO3)6]= 0.1000mol·L-1×50.00×10-3L=5.000×10-3mol
n[(NH4)2Fe(SO4)2]= 0.0500mol·L-1×24.00×10-3L=1.200×10-3mol
与NaN3反应的n[(NH4)2Ce(NO3)6]= 5.000×10-3mol-1.200×10-3mol
=3.800×10-3mol
ω= =0.9880 (共6分)
=0.9880 (共6分)
【解析】
试题分析:配置一定物质的量浓度的溶液需用到250mL容量瓶、胶头滴管等仪器;(2)该物质只有两种元素,故只能生成氮气和金属钠;(3)该操作的原理是加入一定量的(足量)(NH4)2Ce(NO3) 6反应完全NaN3,再滴定剩余的(NH4)2Ce(NO3)6,根据差值计算出上述反应中反应物的量,故仰视滴定管导致标准液读数偏大,溶液体积增大,第一步反应(NH4)2Ce(NO3) 6量偏少,样品中叠氮化钠质量分数变小;
(4)总量n[(NH4)2Ce(NO3)6]= 0.1000mol·L-1×50.00×10-3L=5.000×10-3mol
参与第二步反应的量 n[(NH4)2Fe(SO4)2]= 0.0500mol·L-1×24.00×10-3L=1.200×10-3mol
与NaN3反应的n[(NH4)2Ce(NO3)6]= 5.000×10-3mol-1.200×10-3mol
=3.800×10-3mol
ω= =0.9880
=0.9880
考点:考查定量测定计算与分析有关问题。


科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:填空题
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
B元素原子的核外p电子总数比s电子总数少1 |
C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
E是第七列元素 |
F是第29号元素 |
(1)A的基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(2)E2+的基态核外电子排布式为 。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是 。由B、C二种元素组成的分子与AC2互为等电子体的分子的结构式为 。(用化学式表示)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。
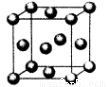
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如图),又知该晶体的密度为9.00g/cm3,晶胞中该原子的配位数为 ;F的原子半径是 cm;(阿伏加德罗常数为NA,要求列式计算)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
下列有关实验装置的说法中正确的是
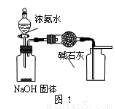
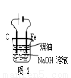
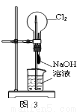
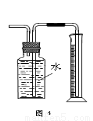
A.用图1装置制取干燥纯净的NH3
B.用图2装置实验室制备Fe(OH)2
C.用图3装置可以完成“喷泉”实验
D.用图4装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O
B.二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
C.硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3·H2O+H2O
D.碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
化学与材料、生活和环境密切相关。下列有关说法中错误的是
A.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D.新型材料聚酯纤维、光导纤维都属于有机高分子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下表中根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 | 石灰水变浑浊 | W可能是Na2CO3 |
B | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | X一定是浓盐酸 |
C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀, 后溶液又变红 | Y中一定含有SO42-和Fe3+ |
D | 少量气态炔烃Z通入pH=a的溴水中 | 溴水褪色,溶液的pH仍约为a | Z与溴发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③ B.①③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
五颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是
①新制氯水久置后→浅黄绿色消失;
②淀粉溶液遇碘单质→蓝色;
③氯化铁溶液滴入甲苯中→紫色;
④热的黑色氧化铜遇乙醇→红色
A.①③④ B.①②④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:选择题
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
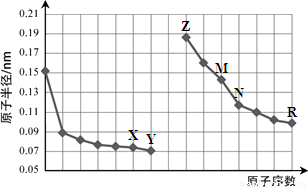
A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X > Z > M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质不能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com