
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH﹣)=1×10﹣20的溶液,其pH为 ,此时水的电离受到 .
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2·L﹣2,则该温度下:100mL 0.1mol·L﹣1H2SO4溶液与100mL 0.4mol·L﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣,下列分析结果肯定错误的是 .
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a mol·L﹣1的氨水与0.01mol·L﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显 (填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:HClO:Ka=3×10﹣8;H2CO3:Ka1=4.3×10﹣7;Ka2=5.6×10﹣11;84消毒液中通入少量的CO2,该反应的化学方程式为  .
.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届内蒙古高三上月考四化学卷(解析版) 题型:选择题
短周期元素W、X、Y、Z原子序数依次增大。X是原子半径最大的短周期元素,Y原子最外层电子数和电子层数相等,W、Z同主族且原子序数之和与X、Y原子序数之和相等。下列说法中不正确的是
A. 含Y元素的盐溶液可呈碱性
B. X和W形成的化合物可含非极性共价键
C. Y单质与Z的最高价氧化物对应水化物反应一定产生H2
D. W的气态氢化物热稳定性强于Z的气态氢化物热稳定性
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三上学期期中化学试卷(解析版) 题型:选择题
下列现象或事实可用同一原理解释的是( )
A.SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
B.浓硫酸和浓盐酸长期暴露在空气中浓度降低
C.不能用pH试纸测定浓硫酸和新制氯水的pH
D.亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期期中化学卷(解析版) 题型:选择题
如图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是( )

A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO32-+7H2O
D.电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期期中化学卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明的溶液中:K+、Cu2+、NO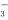 、Cl-
、Cl-
B.0.1 mol·L-1CaCl2溶液中:Mg2+、NH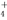 、C
、C O
O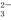 、SO
、SO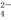
C.pH=12的溶液:Na+、K+、SiO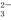 、Cl-
、Cl-
D.使甲基橙变红的溶液中:Na+、Fe2+、NO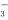 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省娄底市等五校高二上期中化学卷(解析版) 题型:选择题
Zn还原SiCl4的反应如下:
SiCl4(g)+2Zn(l) Si(s)+2ZnCl2(g)ΔH1
Si(s)+2ZnCl2(g)ΔH1
SiCl4(g)+2Zn(g) Si(s)+2ZnCl2(g)ΔH2
Si(s)+2ZnCl2(g)ΔH2
下列说法正确的是
A.Zn(l)=Zn(g)ΔH=1/2(ΔH1-ΔH2)
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加Zn(g)的量,ΔH2变 大
大
D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省娄底市等五校高二上期中化学卷(解析版) 题型:选择题
常温下,对下列四种溶液的叙述正确的是( )
① | ② | ③ | ④ | |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.四种溶液分别加水稀释10倍,pH变化最大的是①和④
B.②、④两溶液相比,两者的kw相同
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为:
c(NH4+)>c(Cl-)>c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市四校高一期中联考化学试卷(解析版) 题型:选择题
化学方程式为3MnO2+6KOH+KClO3 3K2MnO4+KCl+3H2O,下列说法中正确的( )
3K2MnO4+KCl+3H2O,下列说法中正确的( )
A.反应中MnO2是氧化剂
B.该反应属于复分解反应
C.KClO3在反应中失去电子
D.反应中每生成lmolK2MnO4,氧化剂得到2mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高二上学期期中化学试卷(解析版) 题型:填空题
煤和煤制品(如水煤气、焦炭、甲醚等)已广泛应用于工农业生产中。
(1)已知:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3 kJ.mol-l
CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.3 kJ.mol-l
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为____________,该反应在_________(填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)利用炭还原法可处理氮氧化物(如NO等),发生的反应为C(s)+2NO(g) N2 (g)+ CO2 (g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如下表所示:
N2 (g)+ CO2 (g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如下表所示:

①10~20 min内,N2的平均反应速率可v(N2)=____________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(填字母)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.遁当缩小容器的体积
(3)研究表明,反应CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示:

若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol.L-l,在该条件下达到平衡时,CO的转化率为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com