
| A. | 四种元素的最简单气态氢化物中W的沸点最高 | |
| B. | W、X、Y、Z的简单阴离子都会促进水的电离 | |
| C. | 原子的半径:Y>Z>W>X | |
| D. | YX2、YX3通入BaCl2溶液中均有白色沉淀生成 |
分析 W的气态氢化物的水溶液显碱性,应为氨气,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,应为ⅥA族元素,则X为O元素,Y为S元素,W、X、Y、Z是原子序数依次增大的短周期主族元素,则Z应为Cl元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答 解:W的气态氢化物的水溶液显碱性,应为氨气,则W为N元素,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍,应为ⅥA族元素,则X为O元素,Y为S元素,W、X、Y、Z是原子序数依次增大的短周期主族元素,则Z应为Cl元素,
A.水分子中存在氢键,则四种元素的最简单气态氢化物中X的沸点最高,故A错误;
B.Z为Cl元素,对应的氢化物为强电解质,阴离子不发生水解,不会破坏水的电离平衡,故B错误;
C.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子的半径大小为:Y>Z>W>X,故C正确;
D.YX2、YX3分别为SO2、SO3,二氧化硫不与氯化钡溶液反应,则不会生成白色沉淀,故D错误;
故选C.
点评 本题考查原子结构和元素周期律,为高频考点和常见题型,题目难度中等,侧重考查学生分析、推断能力,明确元素周期律内涵即可解答,注意掌握非金属性、金属性强弱判断方法.


科目:高中化学 来源: 题型:选择题
| A. | 3.2g | B. | 6.4g | C. | 9.6g | D. | 12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
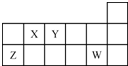
| A. | 原子半径的大小顺序:rZ>rY>rX | |
| B. | Y的简单氢化物水溶液呈酸性 | |
| C. | Y的氢化物与W的氢化物不能发生反应 | |
| D. | X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 表示乙醇燃烧热的热化学方程式(△H的绝对值正确):C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ•mol-1 | |
| B. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O | |
| D. | 用硫酸酸化的橙色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可以用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
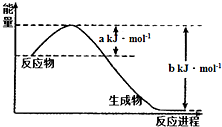 碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响. CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;
CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;| 温度/℃ | n (C)/mol | n(CO2)/mol |
| T1 | 0.3 | |
| T2 | 0.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
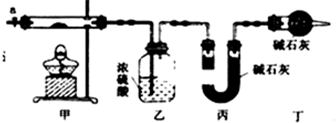
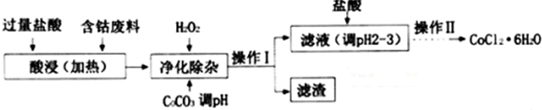
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀的pH | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④②①③ | B. | ②④①③ | C. | ④①②③ | D. | ②④③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①H2SO4溶液中HSO4- | ②NaHSO4溶液中HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com