

| A. | 用水润湿的pH试纸测量某溶液的pH | |
| B. | 用量筒量取20 mL 0.5000 mol•L-1 H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol•L-1 H2SO4溶液 | |
| C. | 实验室用图①所示装置制取少量氨气 | |
| D. | 实验室用图②所示装置除去Cl2中的少量HCl |
分析 A.用水润湿的pH试纸,溶液稀释;
B.配制成0.1000 mol•L-1 H2SO4溶液需要100mL容量瓶;
C.收集氨气的试管口不能密封;
D.HCl极易溶于水,食盐水抑制氯气的溶解.
解答 解:A.用水润湿的pH试纸,溶液稀释,则测定pH时试纸不能润湿,故A错误;
B.配制成0.1000 mol•L-1 H2SO4溶液需要100mL容量瓶,应在烧杯中稀释、冷却后转移到容量瓶中定容,故B错误;
C.收集氨气的试管口不能密封,可塞一团棉花,故C错误;
D.HCl极易溶于水,食盐水抑制氯气的溶解,则用图②所示装置除去Cl2中的少量HCl,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力、实验能力的考查,把握相关物质的性质、实验操作、实验技能为解答的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 乙醇和水,乙醛和水,乙酸和乙醇 | |
| D. | 油脂和水,甲苯和水,乙醇和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2升的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数为4NA | |
| C. | 标准状况下,11.2升二氯甲烷所含分子数为0.5NA | |
| D. | 现有C2H4、C3H6、C4H8的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
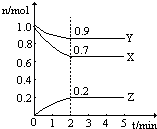 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
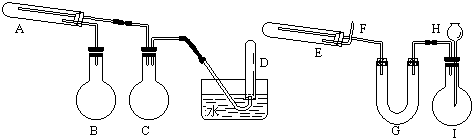
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
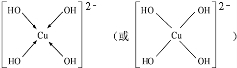
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中消耗铝的质量相同 | |
| B. | 反应中转移的电子数相同 | |
| C. | 反应中消耗的HCl与NaOH物质的量相同 | |
| D. | 溶液增加的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的溶液中:K+、Na+、AlO2-、CO32- | |
| B. | 在0.1mol•L-1的NaHCO3 溶液中:K+、Al3+、I-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com