
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
科目:高中化学 来源: 题型:多选题
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷的一氯代物只有一种结构证明甲烷是正四面体结构而非平面正方形结构 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g 由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | Na2O和Na2O2中阴阳离子个数比都为1:2 | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 标准状况下,11.2L H2O中含有的分子的数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二乙基-1-戊烯 | D. | 3,4-二甲基-4-乙基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
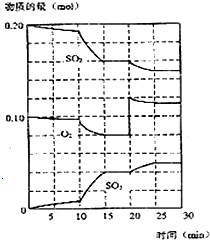 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-190kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通人Y气体,发生反应:X(s)+aY(g)?bZ(s)+W(g);△H>0平衡时Z的物质的量与通人Y的物质的量的变化关系如图所示.下列说法中正确的是( )
在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通人Y气体,发生反应:X(s)+aY(g)?bZ(s)+W(g);△H>0平衡时Z的物质的量与通人Y的物质的量的变化关系如图所示.下列说法中正确的是( )| A. | 平衡时Y的转化率为$\frac{a}{b}$% | |
| B. | 向容器中再加入少量X,则Y的转化率增大 | |
| C. | 再通入Y,重新达到平衡时W的体积分数不变 | |
| D. | 保持压强一定,当原反应在较高温度下建立平衡时,图中θ<45° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com