
【题目】一种碱性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点。其电池总反应为![]() ,下列说法不正确的是
,下列说法不正确的是
A. 电极正极可用多孔碳材料制成
B. 电池负极发生的反应为![]()
C. 理论上,1mol二甲醚放电量是1mol甲醇(![]() )放电量的2倍
)放电量的2倍
D. 电池工作时, ![]() 向电池负极迁移
向电池负极迁移
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】Fe2O3+2Al![]() Al2O3+2Fe所属基本反应类型是______。在该反应中______元素的化合价升高,该元素的原子______电子,被______。该反应中,Fe2O3发生了________反应,Al发生了______反应,______是氧化剂,__是还原剂,______是氧化产物,_____是还原产物。
Al2O3+2Fe所属基本反应类型是______。在该反应中______元素的化合价升高,该元素的原子______电子,被______。该反应中,Fe2O3发生了________反应,Al发生了______反应,______是氧化剂,__是还原剂,______是氧化产物,_____是还原产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白钠镁矾(mNa2SO4·nMgSO4·xH2O)俗称硝板,工业上用白钠镁矾制备碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]晶须的过程如下:向碳酸钠溶液中加入白钠镁矾,保持50℃加热0.5h,有大量的5MgCO3·3H2O生成,然后升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶体。
(1)热解反应的方程式为________________。
(2)碱式碳酸镁可用作化学冷却剂,原因是________________。
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340 g溶于水配成100.00 mL溶液A;
②取25.00 mL溶液A,加入足量的氯化钡溶液,得BaSO4 1.165 g;
③另取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2+ + H2Y2-=MgY2-+ 2H+),滴定至终点,消耗标准溶液25.00 mL。通过计算确定白钠镁矾的化学式(写出计算过程)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
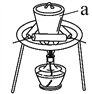
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
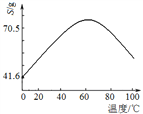
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在固定体积的密闭容器中反应,达到平衡状态的标志是
2NO+O2在固定体积的密闭容器中反应,达到平衡状态的标志是
(1)单位时间内生成n mol O2的同时,生成2n mol NO2
(2)单位时间内生成n mol O2的同时,生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. 仅(1)(4)(5) B. 仅(2)(3)(5)
C. 仅(1)(3)(4) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K 时,0.1 mol/L H2R溶液中H2R、HR、R2 三种微粒的分布系数δ随 pH 变化的关系如图所示。已知:298 K时,HF的Ka=1.0×103.4。下列表述正确的是
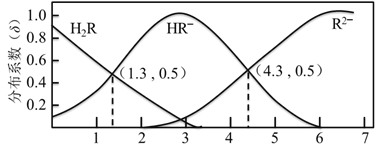
A. H2R的Ka1 = 1.0×101.3
B. Na2R 溶液中离子存在关系:c(Na+) = c(HR ) +2c(R2 )
C. 等物质的量的NaHR 和Na2R溶于水,所得溶液的pH 恰好为4.3
D. 在足量的NaF 溶液中加入少量 H2R 溶液:H2R + 2F = 2HF + R2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚醛树脂是应用广泛的高分子材料,可用酚类与醛类在酸或碱的催化下相互缩合而成,类似的合成过程如:
反应①
反应②
(1)化合物Ⅰ的分子式______。
(2)苯酚与浓溴水反应的化学方程式为__________________。
(3)化合物Ⅱ 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为___________________________________;写出有机物Ⅱ与足量NaHCO3反应的化学方程式________________________________。
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为___________________________________;写出有机物Ⅱ与足量NaHCO3反应的化学方程式________________________________。
(4)有关化合物Ⅱ和Ⅲ的说法正确的有____(填字母)。
A.都属于芳香烃 B.含有官能团种类相同,性质也完全相同
C.二者互为同系物 D.1mol的Ⅱ或Ⅲ都能与2mol的NaOH完全反应
(5)符合下列有条件的化合物Ⅱ的同分异构体有_________种,写出其中苯环上一元取代只有两种的异构体的结构简式_________________________________。
①遇FeCl3溶液发生显色反应 ②可以发生银镜反应 ③可以发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com