
| ||
| ||


科目:高中化学 来源: 题型:
| Na | Mg | Al | Si | P | S | Cl | Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 H、C、N、O、Na、S、Cl、Fe、Cu是常见的九种元素.
H、C、N、O、Na、S、Cl、Fe、Cu是常见的九种元素.查看答案和解析>>
科目:高中化学 来源: 题型:
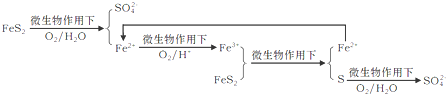
| O2/H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质的密度依次增大 |
| B、单质的熔、沸点依次升高 |
| C、Cl2可从KBr溶液中氧化出Br2 |
| D、F2可从NaCl溶液中氧化出Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4) |
| B、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小:①=②>③ |
| C、0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
| D、0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并 发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并 发生爆炸.则下列判断正确的是( )| A、元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 |
| B、由于键能R-H大于T-H,元素R、T对应气态氢化物的沸点:HR>HT |
| C、R与Q的电子数相差16 |
| D、最高价氧化物对应的水化物的酸性:X<T<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向盐酸中滴加氨水:H++OH-=H2O |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2 NO↑+4H2O |
| D、CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com