
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时v正(O2)=![]() v逆(NO)
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
【答案】D
【解析】
本题主要考查化学平衡的影响因素。
A.![]() 为可逆反应,不能完全转化;
为可逆反应,不能完全转化;
B.平衡时,不同物质的正逆反应速率之比等于化学计量数之比;
C.该反应为气体体积增大的反应,则降低压强,平衡正向移动;
D.该反应为放热反应,升高温度,平衡逆向移动。
A. 为可逆反应,不能完全转化,则4molNH3和5molO2反应,达到平衡时放出热量小于905.9kJ,故A错误;
B. 平衡时,不同物质的正逆反应速率之比等于化学计量数之比,则平衡时5v正(O2)=4v逆(NO),故B错误;
C. 该反应为气体体积增大的反应,则降低压强,平衡正向移动,气体的物质的量增大,由M=![]() 可知,混合气体平均摩尔质量减小,故C错误;
可知,混合气体平均摩尔质量减小,故C错误;
D. 该反应为放热反应,升高温度,平衡逆向移动,则混合气体中NO含量降低,故D正确;
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示,(球大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中正确的是
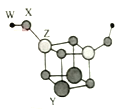
A.Y、Z的简单离子均不影响水的电离平衡
B.工业上获得Y、Z单质均可采用电解它们的熔融氯化物
C.Y的最高价氧化物对应水化物的碱性比Z的弱
D.相同条件下,W单质的沸点比X单质的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由工业合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及以下四个可逆反应:
甲醇合成反应:
(i)CO(g) +2H2(g)==CH3OH(g) △H 1=-90.1kJ·mol-1;
(ii)CO2(g)+3H2(g)== CH3OH(g) +H2O(g) △H2=-49.0kJ·mol-1;
水煤气变换反应:(iii)CO(g)+ H2O(g)==CO2(g)+ H2(g) △H3=-41.1kJ·mol-1;
二甲醚合成反应:(iv)2CH3OH(g) ==CH3OCH3(g)+ H2O(g) △H4=-24.5kJ·mol-1;
①由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:___________________________________。
②反应( ii )的平衡常数表达式为K=______________。
(2)现以二甲醚燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72-),实验室利用如图2装置模拟该法:
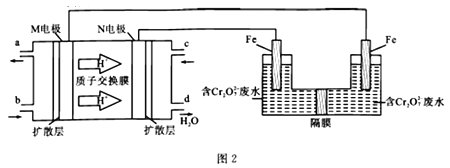
①M电板(a为CO2)的电极反应式为________________________;电解池阳极的电极反应式为_______________________________________。
②请写出电解池中Cr2O72-转化为Cr3+的离子反应方程式:__________________________。
③已知25 ℃时,Ksp[Cr(OH)3]=6.4×10-31。一般以离子浓度≤1×10-5 mol/L作为该离子除尽的标准。处理废水时,最后Cr3+以Cr(OH)3形式除去,当溶液的pH=6时,c(Cr3+)=______,Cr3+ ___ (填“是”或“否”)被除尽。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修3:物质结构与性质)“可燃冰”是蕴藏于海底的一种潜在能源。它由盛有甲烷、氮气、氧气、硫化氢等分子的水分子笼构成。
(1)水分子间通过______相互结合构成水分子笼。N、O、S元素第一电离能由大到小的顺序为________(填元素符号)。
(2)从海底取得的“多金属结核”样本,样本中含铁、锰等多种金属。
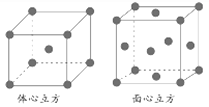
①基态铬原子的电子排布式为________________。
②金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下:

①写出基态Cu2+的核外电子排布式_______。
②胆矾中含有的粒子间作用力是_______(填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1 mol CN-中π键的数目为_______。
胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
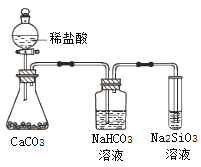
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)![]() Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①中和含酸废水工业常用的试剂x是_____。
②写出H2S气体与足量NaOH溶液反应的化学方程式____。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求填空:
(1)写出![]() 中的官能团的名称_____;
中的官能团的名称_____;
(2)![]() 的名称是___________;
的名称是___________;
(3)CH2=CH—CH3在催化剂加热条件下生成聚合物的反应方程式为__________ ;
(4)写出实验室制乙烯的化学反应方程式____________;
(5)①称取34g某有机化合物A,完全燃烧后生成18gH2O和88gCO2,已知该有机物的蒸气对氢气的相对密度为68,则该有机物的分子式为_____________;
②该有机物A的核磁共振氢谱和红外光谱如下:
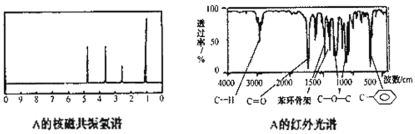
试推测有机物A的结构简式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com