
【题目】下列物质中,既能跟盐酸反应又能跟NaOH溶液反应的化合物是( )
A.AlB.Al(OH)3C.Na2CO3D.SiO2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图,请回答下列问题:

(1)若在原电池中,a电极有气泡产生,b电极逐渐变细,则该原电池的正极是___(填写字母“a”或“b”),外电路中电流流动的方向是___,b电极发生的反应类型是____(填“氧化反应”或“还原反应”)。
(2)当电极a为Zn、电极b为Ag、电解质溶液为CuSO4时,写出该原电池总的离子反应方程式:____,正极的电极反应式为____。当a极溶解的质量为6.5g时,有_____mol电子通过导线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 能使甲基橙变红的溶液:Na+、NH4+、NO3-、CO32-
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl-、SCN-
C. 常温下,![]() =1×10-14的溶液:K+、Na+、AlO2-、CO32-
=1×10-14的溶液:K+、Na+、AlO2-、CO32-
D. 加入Al能放出大量H2的溶液:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.6mol氧气的空气(忽略CO2),放入0.5 L 恒温恒容的密闭容器内,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),测得n(O2)随时间的变化如下表:
2SO3(g),测得n(O2)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | a | a | a |
反应达到5s 后,将容器中的混合气体通入过量的NaOH溶液,气体体积减少了22.4L(已折算为标准状况,忽略吸收O2);再将剩余气体通入过量焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(已折算为标准状况)。请回答下列问题:
(1)用SO2表示从0~1s内该反应的平均反应速率为_______。
(2)反应前容器中SO2的浓度为_______。
(3)混合气体通入过量的NaOH溶液,发生反应的离子方程式为_______。
(4)4s~5s 时,下列说法正确的是_______(填字母)。
A.SO2的生成速率等于O2的消耗速率
B.SO2与O2的浓度比不变
C.混合气体的平均相对分子质量不变
D.该反应已停止
(5)该反应达到平衡时SO2的转化率是_______ (用百分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1 g甲烷不完全燃烧生成CO和液态水时放出37.96 kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=______kJ·mol-1
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
①下列措施能够使该反应速率加快的是______。
a.使用催化剂 b.降低温度 c.及时分离水
②若上述反应在恒容的密闭容器中进行,下列叙述中不能说明该反应已达平衡状态的是______。
a.容器内气体的压强不再变化 b.混合气体的质量不再变化
c.c(NO2) = 2c(N2) d.单位时间内生成1molCO2,同时生成2molNO2
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
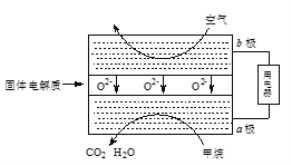
①外电路电子移动方向:____。(填“a极到b极”或“b极到a极”)。
②b极电极反应式为______。
③若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积分数为20%),则理论上消耗甲烷______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)![]() HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
HNO3(aq)+HNO2(aq) ΔH=116.1 kJ·mol1
3HNO2(aq)![]() HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol1
反应3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
2HNO3(aq)+NO(g)的ΔH=___________kJ·mol1。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:____________________________________。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为__________mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图1)。

反应相同时间NOx的去除率随反应温度的变化曲线如题20图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
A.Cu和FeCl3B.Na与O2C.NaOH与CO2D.NaOH与AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18O是一种示踪原子,用来探究反应历程。在密闭容器中加入CO和H218O发生反应CO+H218O![]() CO2+H2,一段时间后达到平衡,18O存在于下列哪些微粒中
CO2+H2,一段时间后达到平衡,18O存在于下列哪些微粒中
A. 只存在于CO2中B. 只存在于CO中
C. 存在于CO2和H2O中D. 存在于CO、H2O和CO2中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com