
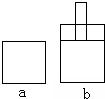
 如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.
如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.| A、反应起始时,两容器内反应速率va和vb的关系为:va=vb |
| B、反应过程中,两容器内反应速率va和vb的关系为:va<vb |
| C、反应达平衡时,两容器内反应物的转化率αa和αb的关系为:αa<αb |
| D、反应达平衡时,两容器内压强Pa和Pb的关系为:Pa>Pb |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、③④ |
| C、①③④ | D、①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
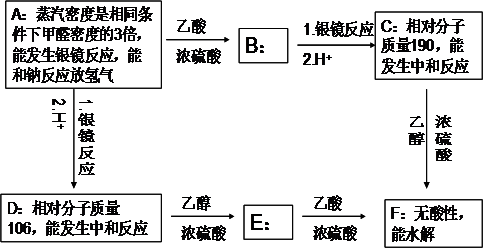
查看答案和解析>>
科目:高中化学 来源: 题型:
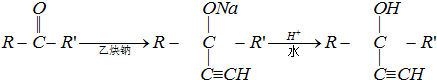
 (碳碳双键)在一定条件下与氧化剂作用,如:
(碳碳双键)在一定条件下与氧化剂作用,如:
查看答案和解析>>
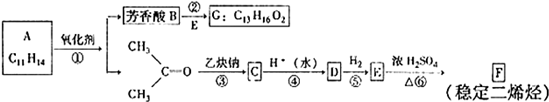
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
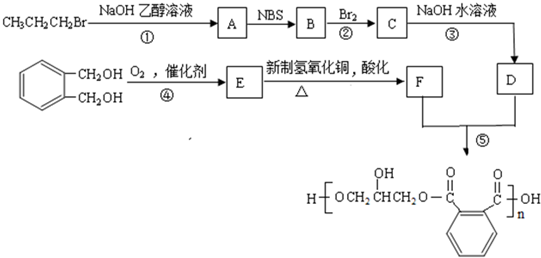
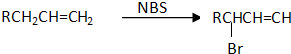
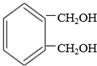 互为同分异构体的结构简式
互为同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HCOOH) |
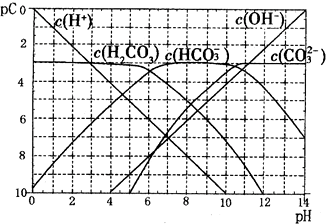
查看答案和解析>>
科目:高中化学 来源: 题型:
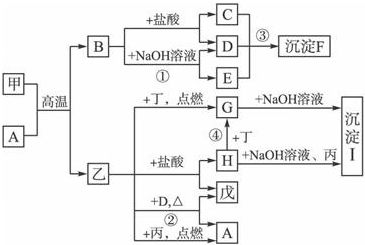 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com