
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
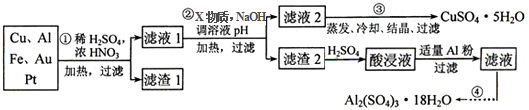
分析 用稀硫酸和浓硝酸的混合液在加热条件下溶解含Cu、Al、Fe及少量Au、Pt等金属的混合物,Cu、Al、Fe溶解,过滤除去不溶的Au、Pt(滤渣1),得滤液1(金属离子为Cu2+、Al3+、Fe2+),向滤液1中加入双氧水氧化溶液里的Fe2+,然后滴加NaOH溶液调节溶液pH范围4.4≤pH<4.9,促进Fe3+、Al3+水解完全生成Fe(OH)3、Al(OH)3,并过滤得到滤渣2和滤液2,滤液2经蒸发冷却、结晶、过滤得到胆矾晶体,滤液2用稀硫酸溶解后用Al置换Fe3+生成Fe,并过滤得滤液,同样蒸发冷却、结晶、过滤得到硫酸铝晶体,
放电时,负极失去电子发生氧化反应;根据K2FeO4中铁的化合价由+6变化为+3,化合价降低3;正反应中Fe元素的化合价降低,K2FeO4为正极,则充电时为阳极,发生氧化反应据此分析作答.
解答 解:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生了反应,所以滤渣1的成分是Pt和Au;
故答案为:Au、Pt;
(2)①第②步加入试剂X的作用是将Fe2+氧化为Fe3+,双氧水与亚铁离子的反应为:2Fe2++H2O2+2H+=2Fe3++2H2O,双氧水做氧化剂被还原后为水,不引入杂质,对环境无污染,而高锰酸钾溶液、漂白粉、氯气做氧化剂,反应后引进了装置,且污染环境,所以试剂X最好选用双氧水;
故答案为:d;
②调溶液PH的目的是使Fe3+和Al3+形成沉淀,依据图表数据分析可知,铁离子完全沉淀时溶液pH=3.7,铝离子完全沉淀时溶液pH=4.4,而铜离子开始沉淀时的pH=4.9,所以使Fe3+和Al3+形成沉淀,铜离子不沉淀,溶液pH调节范围应该为:4.4≤pH<4.9;
故答案为:4.4≤pH<4.9;
(3)亚铁离子有还原性,铁离子使KSCN溶液显血红色,可加入KSCN溶液,检验铁离子,在加入氧化剂检验亚铁离子,方法为:①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+;
故答案为:①取少量滤液于试管中,②向其中加入少量KSCN溶液,如果溶液不变红证明不存在Fe3+,③继续向溶液中滴入新制的氯水,如果溶液不变红证明不存在Fe2+;
(4)根据实验流程,酸浸液中含有铁离子和铝离子,向酸浸液中加入铝粉后,铁离子与铝发生反应生成铁和铝离子,反应的离子方程式为Fe3++Al=Al3++Fe;
故答案为:Al+Fe3+=Fe+Al3+;
(5)由CuSO4•5H2O制备CuSO4时,应把CuSO4•5H2O放在坩埚中;
故答案为:坩埚;
(6)放电时,Zn为负极,失去电子,发生电极反应:Zn-2e-+2OH-=Zn(OH)2;
K2FeO4中铁的化合价由+6变化为+3,化合价降低3,所以每有1molK2FeO4被还原,转移电子的物质的量为3mol,
正反应中Fe元素的化合价降低,K2FeO4为正极,则充电时为阳极,发生氧化反应:Fe(OH)3+5OH--3e-=FeO42-+4H2O;
故答案为:Zn-2e-+2OH-=Zn(OH)2;3mol;Fe(OH)3+5OH--3e-=FeO42-+4H2O.
点评 本题考查较为全面,涉及热化学方程式书写、混合物的分离、可充电电池等知识,综合性较强,其中电化学是难点,注意正负极和阴阳极电极反应式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 丙烯和氯气光照--取代 | |
| B. | 乙烯和溴水的反应--氧化 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色--加成 | |
| D. | 乙烯水化法制乙醇--取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中氧化剂和还原剂的物质的量之比为l:2 | |
| B. | XeF4按以上方式与水反应,每生成3molO2转移12mol电子 | |
| C. | XeF2加入水中,在水分子的作用下,将重新生成Xe和F2 | |
| D. | XeF2、XeF4和XeF6在空气中都能长期存放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
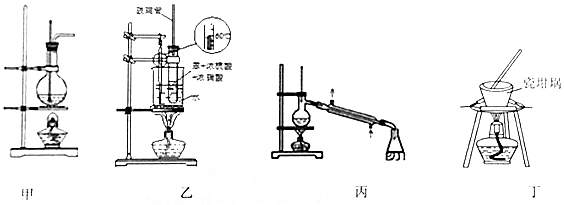
| A. | 装置甲:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 | |
| B. | 装置乙:实验室中可用此装置来制备硝基苯 | |
| C. | 装置丙:实验室中可用此装置来分离含碘的四氯化碳溶液,最终在锥形瓶中收集到碘 | |
| D. | 用装置丁加热熔融NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | 滴入KSCN显血红色的溶液中:NH4+、Mg2+、SO42-、Cl- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com