
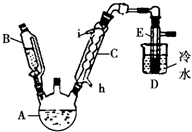
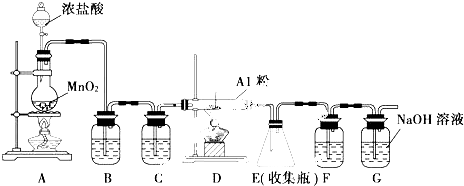
 如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.
如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.| 乙醇 | 溴乙烷 | 溴 | |
| 通常情况下状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
分析 浓硫酸和溴在加热条件下反应生成溴,溴和乙醇在加热条件下发生取代反应生成溴乙烷,A装置用于制取溴乙烷,C装置回流冷却,D装置制取溴乙烷;
(1)A、B仪器分别是三颈瓶、滴液漏斗;
(2)冷凝管中冷却剂采用逆流方法;
加入水可以降低浓硫酸浓度,减少副反应的发生;减少溴的挥发;减少溴化氢的挥发等;
(3)温度越高化学反应速率越大且蒸出溴乙烷;冷却时能使物质由气态转化为液态而易于收集;
(4)加热条件下,浓硫酸和HBr反应生成溴;在加热条件下HBr和乙醇发生取代反应生成溴乙烷;
(5)蒸出的溴乙烷中含有溴单质,溴单质能和亚硫酸钠反应生成NaBr;分液时上层液体从上口倒出,下层液体从下口倒出.
解答 解:浓硫酸和溴在加热条件下反应生成溴,溴和乙醇在加热条件下发生取代反应生成溴乙烷,A装置用于制取溴乙烷,C装置回流冷却,D装置制取溴乙烷;
(1)A、B仪器分别是三颈瓶、滴液漏斗,故答案为:三颈瓶;滴液漏斗;
(2)冷凝管中冷却剂采用逆流方法,所以h是进口、i是出口;
加入水可以降低浓硫酸浓度,减少副反应的发生;溴和HBr易挥发而污染空气,浓硫酸浓度低时能减少溴的挥发、减少溴化氢的挥发等,
故答案为:h;b;
(3)温度越高化学反应速率越大且蒸出溴乙烷,所以加热目的是加快反应速率且使溴乙烷汽化逸出;冷却时能使物质由气态转化为液态而易于收集,所以D装置目的是使溴乙烷液化便于收集,
故答案为:加快反应速率且使溴乙烷汽化;使溴乙烷液化便于收集;
(4)加热条件下,浓硫酸和HBr反应生成溴;在加热条件下HBr和乙醇发生取代反应生成溴乙烷,反应方程式分别为2HBr+H2SO4(浓)$\stackrel{△}{→}$Br2↑+2H2O+SO2↑、HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O,
故答案为:2HBr+H2SO4(浓)$\stackrel{△}{→}$Br2↑+2H2O+SO2↑;HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O;
(5)蒸出的溴乙烷中含有溴单质,溴单质能和亚硫酸钠反应生成NaBr而防止溴污染空气;分液时上层液体从上口倒出,下层液体从下口倒出,溴乙烷在下层而从下面的导管排出来,
故答案为:除去单质溴等杂质;从下面的导管排出来.
点评 本题考查物质制备,为高频考点,涉及实验基本操作、氧化还原反应、物质分离提纯等知识点,明确化学反应原理、基本操作方法及物质性质是解本题关键,注意:该实验中没有直接给出溴单质,是利用浓硫酸和溴化钠制取溴单质,在解答时要注意分析,题目难度不大.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何浓度的溶液都可以用pH来表示其酸碱性的强弱 | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-a mol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)•c(OH-)=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
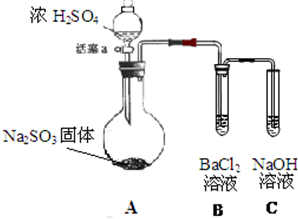 某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):
某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
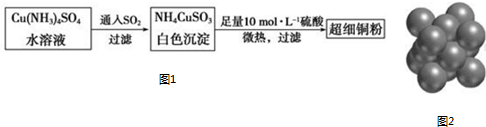
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
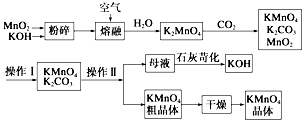
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成份的药量 | 0.245g | 0.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com