
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。A、B、C、D、F均为气体,其中A的相对分子质量为16,F是黄绿色单质;E是最常见的液体;X微溶于水,反应①是工业生产中的重要反应,反应②常用于D的检验。

请回答下列问题:
(1)A的电子式为______。
(2)C的化学式为______。
(3)写出反应①的化学方程式:________________。
(4)写出反应②的离子方程式:________________。
【答案】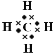 HCl 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca2++2OH-+CO2=CaCO3↓+H2O
HCl 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca2++2OH-+CO2=CaCO3↓+H2O
【解析】
A、B、C、D、F均为气体,其中A的相对分子质量为16,A是甲烷;F是黄绿色单质,F是氯气;E是最常见的液体,E是水;所以B是氧气,D是CO2,C是氯化氢,氧气氧化氯化氢生成氯气和水。X微溶于水,反应①是工业生产中的重要反应,反应②常用于D的检验,则X是氢氧化钙,CO2和氢氧化钙反应生成碳酸钙,即H是碳酸钙,CO2和G反应生成H和I,所以G是次氯酸钙,I是次氯酸,据此解答。
根据以上分析可知A是甲烷,B是氧气,C是氯化氢,D是CO2,E是水,F是氯气,G是次氯酸钙,H是碳酸钙,I是次氯酸,X是氢氧化钙,则
(1)A是甲烷,属于共价化合物,电子式为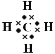 ;
;
(2)C是氯化氢,化学式为HCl;
(3)反应①是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)反应②的离子方程式为Ca2++2OH-+CO2=CaCO3↓+H2O。


科目:高中化学 来源: 题型:
【题目】按照要求计算:
①19.6克硫酸含有_____mol氧原子,将这些硫酸溶于水配成500mL溶液,从其中取出100mL可以消耗1mol/L的NaOH溶液______mL。
②__gH2O2所含原子数与0.2molH3PO4所含原子数相等,该H2O2中所含质子数为__,假设一个铁原子的质量为a克,那么其相对原子质量可表示为__(阿伏加德罗常数为NA)。
③在标准状况下,密度为0.75g/L的氨气和甲烷的混合气体中,氨气的体积分数为_____,该混合气体对氢气的相对密度为______。
④已知agA和bgB恰好完全反应生成0.2molC和dgD,则C的摩尔质量为__。
⑤将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,取出50mL溶液正好与0.02moL的AgNO3溶液完全作用,4.06g的MgCl2·xH2O物质的量为__,式中x的数值____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下浓度均为0.1 mol·L-1的下列各溶液的pH如下表所示,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 若将CO2通入0.1 mol·L-1 Na2CO3溶液中至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol·L-1(忽略溶液体积变化)
C. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的平衡常数K≈10-7.6
HClO+OH-的平衡常数K≈10-7.6
D. 向上述NaClO溶液中通过量CO2气体的离子方程式为:2ClO-+CO2+H2O === 2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为___mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是__(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol·L-1的稀盐酸。
①该学生需要量取__mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、20mL量筒,应选用__mL量筒最好。若量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将___(偏高、偏低、无影响)。
②配制时所需仪器除了量筒外,还需要的仪器有:___。
③下列情况会导致所配溶液的浓度偏低的是__(填字母代号)。
A.浓盐酸挥发,浓度不足 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法和结论正确的是 ( )
A. 加入硝酸银溶液有白色沉淀生成,证明原溶液中一定有Cl-
B. 在加入稀硝酸后的溶液中,再滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定有SO![]()
C. 加入盐酸后加热,放出能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含有CO![]()
D. 加入紫色石蕊试液,溶液显红色,证明溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.8mol/L,O2为0.4mol/L
B. SO2为0.5mol/L
C. SO3为0.8mol/L
D. SO2、SO3一定均为0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验方案①:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验方案②:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验方案③:铝镁合金![]() 溶液
溶液![]() 过滤、洗涤、干燥后测定得到沉淀的质量
过滤、洗涤、干燥后测定得到沉淀的质量
对能否测定出镁的质量分数的实验方案判断正确的是( )
A. 都能B. 都不能C. ①不能,其它都能D. ②③不能,①能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液W中,可能含有K+、Na+、Mg2+、Al3+、Cu2+、NH4+、OH、Cl、CO32-、AlO2-、SiO32-中的一种或几种,其所含的阴离子的物质的量浓度相等,取一定量该溶液,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列有关说法不正确的是
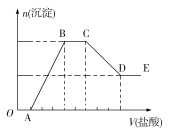
A. 该溶液中至少含有5种离子(不考虑水的电离)
B. B→C分为两个反应阶段,有两个离子反应,且反应过程中有气体生成
C. A点与D点含有同一种元素的离子能反应生成B、C两点含同一种元素的物质
D. 向W溶液中通入B→C产生的气体至过量,产生的沉淀与B点产生的沉淀不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.2mol/L的Na2SO4溶液和50mL0.2mol/L的Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为(设混合前后溶液的体积不变)( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com