
| A. | 标准状况下,5.6 L氯气和16.8 L氧气的混合气体中含有分子数为NA | |
| B. | 标准状况下,22.4 L H2O所含有原子数为3NA | |
| C. | 22.4L CO2所含有的氧原子数为2 NA | |
| D. | 在标准状况下,2.24 L NH3气体中含有氢原子数为3NA |
分析 A、两种气体的混合体积为22.4L,根据分子数为N=$\frac{V}{{V}_{m}}{N}_{A}$来计算;
B、标况下水为液态;
C、二氧化碳所处的状态不明确;
D、求出氨气的物质的量,然后根据1mol氨气中含3mol氢原子来分析.
解答 解:A、两种气体的混合体积为22.4L,含有的分子数为N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{22.4L}{22.4L/mol}{N}_{A}$=NA,故A正确;
B、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、二氧化碳所处的状态不明确,则气体摩尔体积的数值不明确,故其物质的量和氧原子的个数无法计算,故C错误;
D、标况下2.24L 氨气的物质的量为0.1mol,而1mol氨气中含3mol氢原子,故0.1mol氨气中含0.3mol氢原子即0.3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
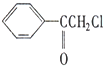 中国是《日内瓦协定书》的缔约国,反对使用化学武器,反对任何形式的化学武器扩散.苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为:
中国是《日内瓦协定书》的缔约国,反对使用化学武器,反对任何形式的化学武器扩散.苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为: 、
、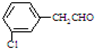 、
、 、
、 、还有
、还有 或
或 (任写一个合理结构).
(任写一个合理结构). 与溴水充分反应,需消耗4mol单质溴;
与溴水充分反应,需消耗4mol单质溴; 与氢气完全加成后的产物的结构简式
与氢气完全加成后的产物的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| D. | 已知I-3?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H18O5 | B. | C14H16O4 | C. | C16H22O5 | D. | C16H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的摩尔质量是18 g | |
| B. | 0.012 kg 12C中约含有6.02×1023个碳原子 | |
| C. | 1 mol水中约含有6.02×1023个氢原子 | |
| D. | 1 mol任何物质都含有6.02×1023个分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com