
根据信息回答下列问题:
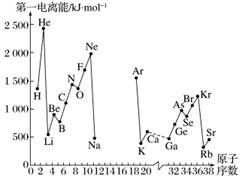
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<______(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是________________。
(3)信息A图中第一电离能最小的元素在周期表中的位置是________周期________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有________性,其中Be(OH)2显示这种性质的离子方程式是________________________________________________________________________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围________________。
(6)请归纳元素的电负性和金属性、非金属性的关系是________________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物,说出理由并写出判断的方法________________________________________________________________________。
答案 (1)Na Mg (2)从上到下依次减小
(3)第五 第ⅠA
(4)两 Be(OH)2+2H+===Be2++2H2O、Be(OH)2+2OH-===BeO +2H2O (5)0.9~1.5
+2H2O (5)0.9~1.5
(6)非金属性越强,电负性越大;金属性越强,电负性越小
(7)Al元素和Cl元素的电负性差值为1.5<1.7,所以形成共价键,为共价化合物 将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物
解析 (1)由信息所给的图可以看出,同周期的ⅠA族元素的第一电离能最小,而第ⅢA族元素的第一电离能小于ⅡA族元素的第一电离能,故Na<Al<Mg。(2)从图中可看出同主族元素的第一电离能从上到下逐渐减小。(3)根据第一电离能的递变规律可以看出,图中所给元素中Rb的第一电离能最小,其在周期表中的位置为第五周期第ⅠA族。(4)根据对角线规则,Al(OH)3与Be(OH)2的性质相似,Be(OH)2应具有两性,根据Al(OH)3+NaOH===NaAlO2+2H2O,Al(OH)3+3HCl===AlCl3+3H2O可以类似地写出Be(OH)2与酸、碱反应的离子方程式。(5)根据电负性的递变规律:同周期元素,从左到右电负性逐渐增大,同主族元素从上到下电负性逐渐减小可知,在同周期中电负性Na<Mg<Al,Be>Mg>Ca,最小范围应为0.9~1.5。(6)因电负性可以用来衡量原子吸引电子能力的大小,所以电负性越大,原子吸引电子的能力越强,非金属性越强,反之金属性越强。(7)AlCl3中Al与Cl的电负性差值为1.5,根据信息,电负性差值若小于1.7,则形成共价键,所以AlCl3为共价化合物。离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物不能导电。


科目:高中化学 来源: 题型:
一定条件下,发生反应:①M(s)+N(g)??R(g) ΔH=-Q1 kJ·mol-1,
②2R(g)+N(g)??2T(g) ΔH=-Q2 kJ·mol-1。Q1、Q2、Q3均为正值。下列说法正确的是( )
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N (g)的能量总和
B.将2 mol R(g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+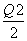 ) kJ
) kJ
D.M(g)+N(g)??R(g) ΔH=-Q3 kJ·mol-1,则Q3<Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
测定Na2S2O3·5H2O产品纯度
准确称取W g Na2S2O3·5H2O产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O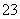 +I2===S4O
+I2===S4O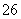 +2I-
+2I-

(5)滴定至终点时,溶液颜色的变化:___________________________。
(6)测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为__________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为_____。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为____________________________________。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n=________;原子中能量最高的是________电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3
C.X2YZ2 D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
基态硼原子的电子排布式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
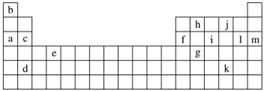
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要
的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素,则该元素属于________区。用元素符号表示X和j所能形成的化合物的化学式是__________。
③Y是周期表中________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关盐类水解的叙述中正确的是( )
A.溶液呈中性的盐一定是强酸、强碱生成的盐
B.含有弱酸根盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱
D.强酸强碱盐的水溶液一定呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com