
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题:
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.请回答下列问题: .
.
分析 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,则X为C元素、Y为O元素、Z为Al元素、W为Si元素、Q为Cl元素,然后结合元素周期律知识解答(1)、(2);
(3)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2与淀粉结合再次出现蓝色,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
④根据关系S2O32-~I-~ClO2先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,则X为C元素、Y为O元素、Z为Al元素、W为Si元素、Q为Cl元素
(1)W为Si元素,原子序数为14,在周期表中位于第三周期IVA族;Y、Z的离子分别为氧离子、铝离子,都含有2个电子层,铝离子的核电荷数较大,则铝离子半径较小,则离子半径由大到小的顺序为:O2->Al3+;由X与氢元素组成四原子化合物为乙炔,乙炔为共价化合物,其电子式为 ,
,
故答案为:第三周期IVA族; O2->Al3+; ;
;
(2)a.XY2和WY2分别为CO2和SiO2,二氧化碳溶于水生成碳酸,但是二氧化硅不溶于水,故a错误;
b.没有指出最高价,则Q的含氧酸的酸性不一定比X的含氧酸的酸性强,故b错误;
c.X的最简单气态氢化物为甲烷,W的最简单气态氢化物为硅烷,非金属性C大于Si,则甲烷的稳定性大于硅烷,故c正确;
d.由NaOH溶液分别滴入MgCl2、AlCl3溶液中,氢氧化钠过量时氢氧化镁不溶解,而氢氧化铝溶解,证明氢氧化镁的碱性大于氢氧化铝,则Mg的金属性大于Al,故d正确;
故答案为:c d;
(3)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,
故答案为:2ClO2+2I-=2ClO2-+I2;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,
故答案为:蓝色消失,半分钟内不变色;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,反应的离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~I-~ClO2
1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg,
由于水样为 1L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1≈0.68mg•L-1,
故答案为:0.68.
点评 本题考查了位置、结构与性质的关系、含量测定实验,题目难度中等,明确原子结构与元素周期律、元素周期表的关系为解答关键,④为易错点,注意计算结构必须精确到0.01,试题培养了学生的分析能力、逻辑推理能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
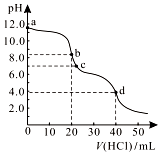 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )| A. | a点溶液呈碱性的原因用离子方程式表示为:CO32-+2H2O?H2CO3+2OH- | |
| B. | c点处的溶液中c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-) | |
| C. | 滴定过程中使用甲基橙作为指示剂比酚酞更准确 | |
| D. | d点处溶液中水电离出的c(H+)大于b点处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 物品标签 |  |  |  |  |
| 分析 | 该试剂应装在橡 胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 受热易分解 | 该药品标签上还标有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3易溶于水,可用作净水剂 | |
| B. | 硅是半导体材料,纯净的硅是光纤制品的基本原料 | |
| C. | 浓硫酸能干燥氯气,说明浓硫酸具有吸水性 | |
| D. | 氨易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
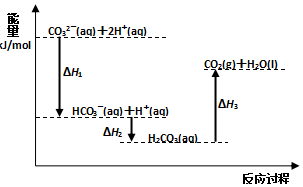
| A. | 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应 | |
| B. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2+△H3) | |
| C. | △H1>△H2△H2<△H3 | |
| D. | H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则△H3变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS2中硫的化合价为-1价 | |
| B. | Fe2O3为氧化产物,SO2是还原产物 | |
| C. | lmolCuFeS2反应转移电子为13mol | |
| D. | 该反应的所有产物均既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Au-e-═Au+ | B. | O2+2H2O+4e-═4OH- | ||
| C. | Au-e-+2CN-═Au(CN)2- | D. | 2H2O+2e-═2OH-+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com