
| A. | 向Na2SiO3溶液中加入稀盐酸 | |
| B. | 将CO2通入CaCl2溶液中 | |
| C. | 向FeCl2溶液中加入过量NaOH溶液 | |
| D. | 向Al2(SO4)3溶液中加入过量NaOH溶液 |
分析 先判断反应是否发生,再根据生成物的溶解性进行判断,难溶性的物质会产生沉淀,白色沉淀有:硅酸、氢氧化铝、难溶的碳酸盐和硫酸盐以及氯化银等,
A.过量二氧化碳和硅酸钠反应生成硅酸白色沉淀;
B.二氧化碳和氯化钙不能反应;
C.氯化亚铁和氢氧化钠反应生成氢氧化亚铁白色沉淀但迅速被空气中氧气氧化生成氢氧化铁红褐色沉淀;
D.硫酸铝溶液和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,当氢氧化钠溶液过量,氢氧化铝会溶解;
解答 解:A、向Na2SiO3溶液中加入稀盐酸会生成硅酸白色沉淀物质,故A正确;
B、二氧化碳气体和氯化钙溶液不发生反应,故B错误;
C、FeCl2溶液中加入过量NaOH溶液会先生成白色的氢氧化亚铁,然后迅速变为灰绿色,最终得到红褐色沉淀氢氧化铁,故D错误;
D、Al2(SO4)3溶液中加入过量NaOH溶液,最终得到偏铝酸钠和硫酸钠溶液,不会生成白色沉淀,故D错误;
故选A.
点评 本题考查了复分解反应的条件,易错选项是D,注意氢氧化铝可以和过量的氢氧化钠反应这一事实是解题的关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列关于有机物
.下列关于有机物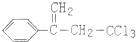 (除草剂,俗称稗草烯)的说法不正确的是( )
(除草剂,俗称稗草烯)的说法不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 在足量NaOH溶液中充分水解,可生成羧酸钠 | |
| C. | 可用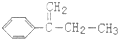 与Cl2在光照条件下通过取代反应获得较纯的该物质 与Cl2在光照条件下通过取代反应获得较纯的该物质 | |
| D. | 在一定条件下可发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
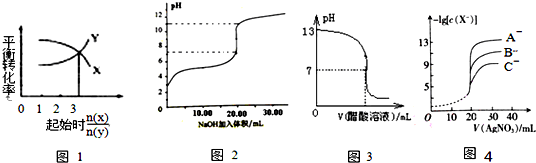
| A. | 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| B. | 图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 | |
| C. | 常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是A- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块沉在乙醇液面下面 | B. | 钠块熔成小球 | ||
| C. | 钠块在乙醇液面上游动 | D. | 钠块表面无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com