




 个σ键来计算σ键的数目,所以1mol C60分子中σ键的数目=
个σ键来计算σ键的数目,所以1mol C60分子中σ键的数目= ×60×NA=90NA;根据均摊法,该晶胞独立分得K原子:2×6×
×60×NA=90NA;根据均摊法,该晶胞独立分得K原子:2×6× =6,独立分得C60:8×
=6,独立分得C60:8× +1=2。
+1=2。

科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1 817 | 2 745 | 11 578 |
| Y | 738 | 1 451 | 7 733 | 10 540 |
| Z | 496 | 4 562 | 6 912 | 9 543 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由二氧化碳合成金刚石是化学变化 | B.金刚石是碳的一种同位素 |
| C.钠被氧化最终生成碳酸钠 | D.金刚石中只含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.SO2 | B.BeCl2 | C.BBr3 | D.COCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 在过量氨水中易转化为
在过量氨水中易转化为 。写出
。写出 的价层电子排布图____。
的价层电子排布图____。 中
中 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中 键和
键和 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
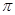 键的个数为 。
键的个数为 。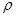 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用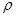 、NA的计算式表示)
、NA的计算式表示)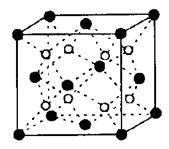
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
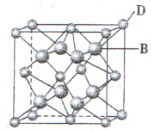
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com