
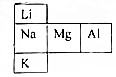
 试分析它们的原子结构(电子层数、最外层电子)请指出:
试分析它们的原子结构(电子层数、最外层电子)请指出:分析 (1)同主族元素最外层电子数相等,但电子层数不同;
(2)同周期元素电子层数相同,但最外层电子数不等;
(3)同主族元素最外层电子数相等,所以化学性质相似.
解答 解:(1)同主族元素最外层电子数相等,所以纵行中,三元素的相同点是最外层电子数,但电子层数不同,三元素的不同点是电子层数,故答案为:最外层电子数;电子层数不同;
(2)同周期元素电子层数相同,所以横行中,三元素的相同点是电子层相同,但最外层电子数不等,三元素的不同点是最外层电子数不等,故答案为:电子层相同;最外层电子数不等;
(3)同主族元素最外层电子数相等,所以化学性质相似,而Li、Na、K三种元素最外层电子数相同,所以三种元素的化学性质更为为相似,故答案为:Li、Na、K.
点评 本题考查元素周期表的结构及应用,为高频考点,把握原子结构与元素位置的性质为解答的关键,注意元素周期律在解题中的应用,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
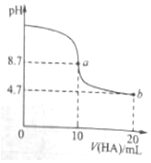 室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(A-)+c(HA)=0.1mol•L-1 | |
| B. | b点所示溶液中c(HA)>c(A-) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | a、b两点所示溶液中水的电离程度a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将一定量的NaNO3和KCl混合加热浓缩至有固体析出,过滤. | 有白色晶体析出 | 白色晶体为KNO3 |
| B | 向2mLNaCl和NaI(浓度均为0.1mol•L-1)混合溶液中滴入2滴0.1mol•L-1AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中加入盐酸酸化的Ba(NO3)2溶液 | 出现白色沉淀 | 该溶液一定有SO42-或 Ag+ |
| D | 向淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸 | 没有生成(砖)红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Si3N4>NaCl>Sil4 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取12.5 g胆矾(CuSO4•5H2O),配成500 mL溶液 | |
| B. | 称取12.5 g胆矾(CuSO4•5H2O),加入500 mL水配成溶液 | |
| C. | 称取7.68 g无水硫酸铜粉末,加入480 mL水配成溶液 | |
| D. | 称取8.0 g无水硫酸铜粉末,加入500 mL水配成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
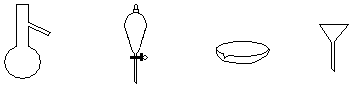
| A. | 蒸发、过滤、蒸馏、分液 | B. | 蒸馏、分液、蒸发、过滤 | ||
| C. | 蒸馏、过滤、蒸发、分液 | D. | 蒸发、分液、蒸馏、过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com