
| n |
| V |
| ||
| 11.2L |
| 22.4L/mol |
| 0.5×2 |
| 0.5 |
| ||


科目:高中化学 来源: 题型:
| A、v(A)=0.15 mol?L-1?min-1 |
| B、v(B)=0.015 mol?L-1?s-1 |
| C、v(C)=0.40 mol?L-1?min-1 |
| D、v(D)=0.45 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液中加入醋酸:CO32-+2H+=H2O+CO2↑ |
| B、稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C、碳酸钙中加入盐酸:CO32-+2H+=H2O+CO2↑ |
| D、氢氧化钠溶液中加入硫酸:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
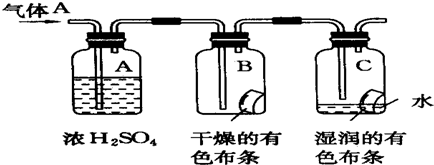
 Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
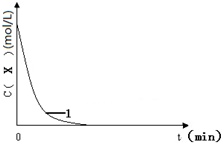 已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-═2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-═2H2O+I2的反应速率.| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01 mol?L-1 X 溶液 | 0.1 mol?L-1 双氧水 | 1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
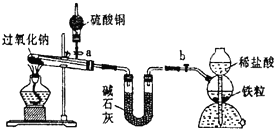
| 气化炉中产生H2 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.6kJ mol-1 ②CO(g)+H2O(g)═CO2(g)+H2(g) △H=-41.2kJ mol-1 ③CaO(s)+CO2(g)═CaCO3(s) △H=-178.3kJ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com