
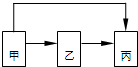
 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )| A. | 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2 | |
| B. | 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3 | |
| C. | 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3 | |
| D. | 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2 |
分析 A、若甲是Al,丙是Al(NO3)3,乙可以是铝和盐酸反应生成的氯化铝,氯化铝和硝酸银反应得到硝酸铝,可以是偏铝酸钠和过量硝酸反应生成硝酸铝;
B、若甲是Al2O3,丙是NaAlO2,乙可以是和盐酸反应生成的氯化铝,氯化铝和过滤氢氧化钠溶液反应得到偏铝酸钠;
C、甲是Al(NO3)3,丙是NaAlO2,乙只能是Al(OH)3 和氢氧化钠反应生成偏铝酸钠;
D、若甲是Al(OH)3,丙是Al(NO3)3,乙可以是氢氧化铝和盐酸反应生成的氯化铝,氯化铝和硝酸银反应得到硝酸铝;
解答 解:A、若甲是Al,丙是Al(NO3)3,乙可以是铝和盐酸反应生成的氯化铝,氯化铝和硝酸银反应得到硝酸铝,可以是偏铝酸钠和过量硝酸反应生成硝酸铝,乙不一定是NaAlO2,故A错误;
B、若甲是Al2O3,丙是NaAlO2,乙可以是和盐酸反应生成的氯化铝,氯化铝和过量氢氧化钠溶液反应得到偏铝酸钠,也可以是硫酸铝和过量氢氧化钠溶液反应得到偏铝酸钠,故乙不一定是Al(NO3)3,故B错误;
C、甲是Al(NO3)3,丙是NaAlO2,乙只能是两性化合物Al(OH)3 和氢氧化钠反应生成偏铝酸钠,故C正确;
D、若甲是Al(OH)3,丙是Al(NO3)3,乙可以是氢氧化铝和盐酸反应生成的氯化铝,氯化铝和硝酸银反应得到硝酸铝,也可以是氢氧化铝溶于氢氧化钠溶液生成的偏铝酸钠,偏铝酸钠和过量硝酸反应得到硝酸铝,故D错误;
故选C.
点评 本题考查了铝及其化合物性质的分析应用,注意氢氧化铝、氧化铝是两性化合物既可以和强酸反应也可以和强碱溶液反应,掌握实质是关键,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与氧元素形成的化合物中可能含有共价键 | |
| B. | 第三周期元素的简单离子中Y离子的半径最小 | |
| C. | Z、W的氧化物均为酸性氧化物 | |
| D. | R元素含氧酸的酸性一定强于W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
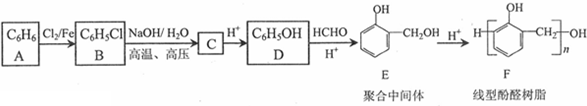
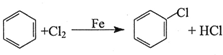 ,反应类型为取代反应
,反应类型为取代反应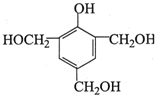
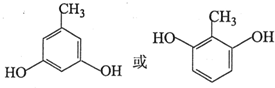 (写出其中一种的结构简式);
(写出其中一种的结构简式);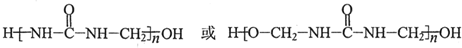 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
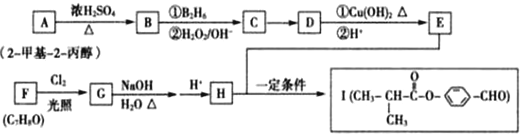
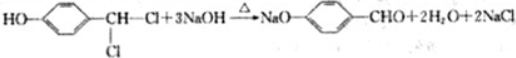 .
.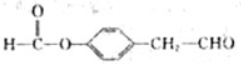 、
、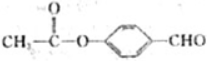 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用盐酸鉴别亚硝酸钠和食盐 | |
| B. | 亚硝酸钠可以加到食品中,但添加量要符合规定 | |
| C. | 亚硝酸钠受热分解放出的气体可能是NH3 | |
| D. | 亚硝酸钠由三种元素组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气象环境报告中的“PM2.5”是一种新分子的描述 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量、 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 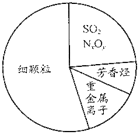 如图为雾霾的主要成分示意图,SO2和NxOy都属于酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com