

| A. | 200℃时,反应从开始到平衡的平均速率 v(A)=0.08 mol•L-1•min-1 | |
| B. | 若 0~5 min 时容器与外界的热交换总量为 m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| C. | 200℃时,若在第 6 min 再向体系中加入催化剂,可使 v 正>v 逆 | |
| D. | 200℃时,平衡后再充入 2 mol C,则达到平衡时,化学平衡常数变小 |
分析 A.由图可知,从开始到平衡A减少可0.8mol-0.4mol=0.4mol,结合v=$\frac{△c}{△t}$计算;
B.从开始到平衡A减少可0.8mol-0.4mol=0.4mol,B减少0.2mol,C增加0.2mol,减少量之比等于化学计量数之比,物质的量与热量成正比,由图II可知,升高温度K增大;
C.催化剂同等程度增大正逆反应速率;
D.K与温度有关,温度不变,K不变.
解答 解:A.由图可知,从开始到平衡A减少可0.8mol-0.4mol=0.4mol,v(A)=$\frac{\frac{0.4mol}{2L}}{5min}$=0.04 mol•L-1•min-1,故A错误;
B.从开始到平衡A减少可0.8mol-0.4mol=0.4mol,B减少0.2mol,C增加0.2mol,减少量之比等于化学计量数之比,物质的量与热量成正比,由图II可知,升高温度K增大,则正反应为吸热反应,2molA参加反应吸热为$\frac{m}{0.4}$×2=5m,该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol,故B正确;
C.催化剂同等程度增大正逆反应速率,则第 6 min 再向体系中加入催化剂,可使 v 正=v 逆,故C错误;
D.K与温度有关,温度不变,K不变,则200℃时,平衡后再充入 2 mol C,则达到平衡时,化学平衡常数不变,故D错误;
故选B.
点评 本题考查物质的量随时间的变化曲线,为高频考点,把握图中物质的量变化、K与温度的关系为解答的关键,侧重分析与应用能力的考查,注意图象分析及应用,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol A,同时生成n mol D | |
| B. | B的浓度保持不变 | |
| C. | 容器内混合气体的密度不随时间而变化 | |
| D. | 单位时间内消耗n mol B,同时消耗n mol A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
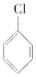 ②
②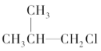 ③(CH3)3C-CH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3C-CH2Cl ④CHCl2-CHBr2 ⑤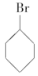 ⑥CH3Cl.
⑥CH3Cl.| A. | ①③⑥ | B. | ②③⑤ | C. | ②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 水杨醛分子中有三种官能团 | |
| B. | 中间体X易溶于水 | |
| C. | 香豆素-3-羧酸能使酸性高锰酸钾溶液褪色 | |
| D. | l mol水杨醛最多能与3 molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com