
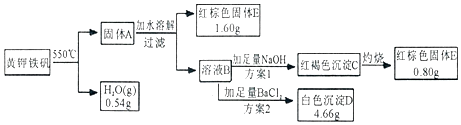
分析 黄钾铁矾550°C加热失去水得到固体A,加水溶解过滤得到红棕色固体E和溶液B,溶液B取两份分别加入足量NaOH生成红褐色沉淀C为氢氧化铁,灼烧得到红棕色固体E,另一份加入足量BaCl2生成白色沉淀D为硫酸钡沉淀,结合元素守恒计算.
解答 解:黄钾铁矾550°C加热失去水得到固体,水的质量0.54g,氢元素守恒得到化学式中氢氧根离子物质的量n(OH-)=$\frac{0.54g}{18g/mol}$×2=0.06mol,
红棕色固体为氧化铁得到氧化铁质量=1.6g+0.8g=2.4g,铁元素守恒得到黄钾铁矾中铁元素物质的量n(Fe)=$\frac{2.4g}{160g/mol}$×2=0.25mol,
方案2生成的白色沉淀为硫酸钡,结合硫元素守恒得到黄钾铁矾中含硫酸根离子物质的量n(SO42-)=$\frac{4.66g}{233g/mol}$=0.02mol,
n(Fe):n(SO42-):n(OH-)=3:x:y=0.03:0.02:0.06=3:2:6,
(1)分析计算得到x=2,y=6,
故答案为:2;6;
(2)分析得到黄钾铁矾盐化学式为:KFeSO4或K2SO4,Fe2(SO4)3,
故答案为:KFeSO4或K2SO4,Fe2(SO4)3;
(3)红褐色沉淀能溶于HI溶液,并发生氧化还原反应,铁离子氧化碘离子生成碘单质,该反应的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,
故答案为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O.
点评 本题考查了物质组成和结构的计算分析判断,主要是离子性质和定量计算的应用,注意元素守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
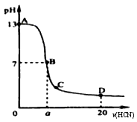 在15mL0.10mol•L-1NaOH 溶液中逐滴加入 0.20mol•L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如图所示,有关粒子浓度大小关系正确的是( )
在15mL0.10mol•L-1NaOH 溶液中逐滴加入 0.20mol•L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如图所示,有关粒子浓度大小关系正确的是( )| A. | 在 A、B 间任意一点:c(Na+)>c(CN-)>c(OH-)>c(H+) | |
| B. | 在 B 点:c(Na+)═c(CN-)>c( OH-)=c(H+),且 a=7.5 | |
| C. | 在 C 点:c(CN-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 在 D 点:c(HCN)+c(CN-)>2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子中四个碳氢键键长相等 | |
| B. | 甲烷分子中四个碳氢键键角相等 | |
| C. | 甲烷分子中四个碳氢键键能相等 | |
| D. | 由于甲烷分子三个键参数都分别相等,所以甲烷的空间构型是平面正方形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com