
【化学—选修5有机化学基础】
姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:
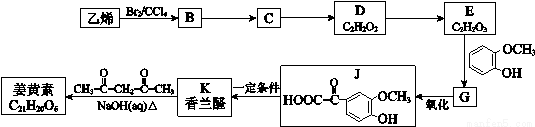
已知:
i.1 mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、2 mol、1 mol。
ii.
iii.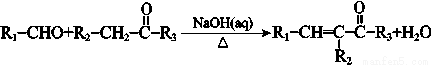 (R1、R2、R3为烃基或氢原子) 请回答:
(R1、R2、R3为烃基或氢原子) 请回答:
(1)B→C的反应类型是 。
(2)C→D反应的化学方程式是 。
(3)E的核磁共振氢谱中有两个峰,E中含有的官能团名称是 。
E→G反应的化学方程式是 。
(4)下列有关香兰醛的叙述不正确的是 。
a.香兰醛能与NaHCO3溶液反应
b.香兰醛能与浓溴水发生取代反应
c.1 mol香兰醛最多能与3 molH2发生加成反应
(5)写出一种符合下列条件的香兰醛的同分异构体的结构简式 。
①苯环上的一硝基取代物有2种
②1 mol该物质水解,最多消耗3 molNaOH
(6)姜黄素的分子中有2个甲基,其结构简式是 。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源:2015-2016学年海南嘉积中学高二下期中理科化学试卷(解析版) 题型:选择题
在卤代烃 中,有关化学键的叙述,下列说法不正确的是
中,有关化学键的叙述,下列说法不正确的是
A.当该卤代烃发生取代反应时,被破坏的键一定是①
B.当该卤代烃发生消去反应时,被破坏的键一定是①和③
C.当该卤代烃在碱性条件下发生水解反应时,被破坏的键一定是①
D.当该卤代烃发生消去反应时,被破坏的键一定是①和④
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三三模理综化学试卷(解析版) 题型:选择题
下列实验装置或操作正确的是
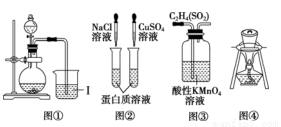
A.图①向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2-
B.图②两支试管中的蛋白质济液均会变性
C.图③装置用来除去C2H4中的杂质SO2
D.图④装置用来灼烧海带成灰
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
已知C-C单键可以绕键轴旋转,结构简式为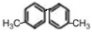 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A.在 FeBr3的催化作用下可与溴水发生取代反应
B.该烃与足量 H2的加成产物一氯代物最多有四种
C.分子中至少有10个碳原子处于同一平面上
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:选择题
一定量的混合气体在密闭容器中发生反应:mA(g)+nB (g) pC (g)达到平衡后,温度不变,将气体体积缩小到原来的 1/2,达到新的平衡时,C 的浓度为原来的1. 8倍,则下列说法正确的是
pC (g)达到平衡后,温度不变,将气体体积缩小到原来的 1/2,达到新的平衡时,C 的浓度为原来的1. 8倍,则下列说法正确的是
A.m + n> p B.A 的转化率降低 C.平衡向正反应方向移动 D.C 的体积分数增加
查看答案和解析>>
科目:高中化学 来源:2016届宁夏石嘴山三中高三下四模理综化学试卷(解析版) 题型:实验题
实验室以苯、乙醛为原料,三氯化铝为催化剂来制备1,1—二苯乙烷,其反应原理为: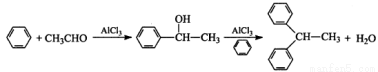
制备过程中的无机产物会与AlCl3发生反应。主要实验装置和步骤如下:
I.合成:
在250 mL三口烧瓶中加入140mL苯(密度0.88g/mL)、19gAlCl3和5.5g乙醛,在20℃时充分反应。
Ⅱ.分离与提纯:
将反应混合物倒入装有150 mL冰水和少量盐酸的烧杯中,充分搅拌,用分液漏斗分离出有机层,依次用水、2%碳酸钠溶液、水洗涤,在分离出的粗产品中加入少量无水硫酸镁固体,过滤后先常压蒸馏除去过量苯再改用减压蒸馏收集170~172℃/6.67kPa的馏分,得12.5g 1,1—二苯乙烷。

(1)仪器a的名称: ;无机产物与AlCl3发生反应的化学方程式为: ;装置c的作用: 。
(2)连接装置b的作用是 。
(3)在洗涤操作中,第二次水洗的主要目的是 ,实验中加入少量无水硫酸镁的目的是 。
(4)粗产品常压蒸馏提纯时,下列装置中温度计位置正确的是 ,可能会导致收集到的产品中混有低沸点杂质的装置是 。
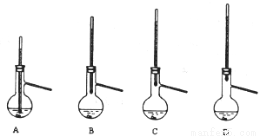
(5)本实验所得到的1,1—二苯乙烷产率约为 (填正确答案的序号)。
A.41% B.48% C.55% D.65%
查看答案和解析>>
科目:高中化学 来源:2016届宁夏石嘴山三中高三下四模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放还原铁粉
B.天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点
C.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
D.若两种二肽互为同分异构体,则二者的水解产物一定不相同
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:填空题
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
(1)如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
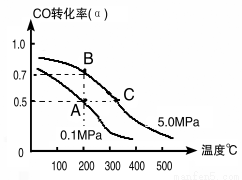
已知:2CO(g)+O2(g)===2CO2(g) △H1=-566kJ·mol-1
2H2(g)+O2(g)===2H2O(l) △H2=-572kJ·mol-1
CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) △H3=-1366kJ·mol-1
H2O(g)===H2O(l) △H4=-44kJ·mol-1
①△H= kJ·mol-1
②若A、C两点都表示达到的平衡状态,则从反应开始到达平衡状态所需的时间tA tC(填“﹥”、“﹤”或“﹦”)。
③若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
④熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极上CO反应的电极反应式为 。
(2)工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(3)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
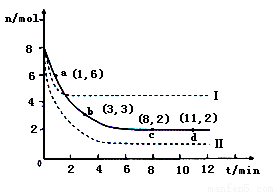
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)将标准状况下4.48L CO2通入1L 0.3mol·L-1 NaOH溶液中完全反应,所得溶液中微粒浓度关系正确的是
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:选择题
根据元素周期律判断,下列关系正确的是:
A.离子半径:S2->Na+ B.热稳定性:HCl>HF
C.酸性:H3BO3>H2CO3 D.碱性:Al(OH)3>Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com