
分析 涉及反应有:2Na2O2+2H2O=4NaOH+O2↑,NaHCO3+NaOH=Na2CO3+H2O,生成n(Na2CO3)=1L×0.4mol/L=0.4mol,可能存在两种情况:①NaHCO3不足,②NaHCO3过量,结合反应的方程式计算.
解答 解:因n(Na2CO3)=1L×0.4mol/L=0.4mol,
则可能存在两种情况:①NaHCO3不足,②NaHCO3过量,
①如NaHCO3不足:
则NaHCO3+NaOH=Na2CO3+H2O,
0.4mol 0.4mol,
n(Na2O2)=1mol-0.4mol=0.6mol,
发生2Na2O2+2H2O=4NaOH+O2↑,
V(O2)=$\frac{1}{2}$×0.6mol×22.4L/mol=6.72L,
②如NaHCO3过量,
NaHCO3+NaOH=Na2CO3+H2O,
0.4mol 0.4mol
n(NaOH)=0.4mol,
则n(Na2O2)=0.2mol,
n(NaHCO3)=1mol-0.2mol=0.8mol,
V(O2)=$\frac{1}{2}$×0.2mol×22.4L/mol=2.24L,
故答案为:6.72;2.24.
点评 本题考查混合物以及化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意根据反应的化学方程式解答该题,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用厨房垃圾发酵制沼气属于物理变化 | |
| B. | 可用水作镁铝合金爆炸时的灭火剂 | |
| C. | 推广使用煤液化技术科减少温室气体二氧化碳的排放 | |
| D. | 超导材料K3C60在熔融状态下能够导电,说明K3C60是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 平衡浓度/(mol•L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y遇到氯化铁溶液时显紫色,X能使溴的四氯化碳溶液褪色 | |
| B. | X含3个手性碳原子 | |
| C. | 1mol X与足量NaOH溶液反应,最多可消耗3mol NaOH | |
| D. | 1个Y分子中最多有8个原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
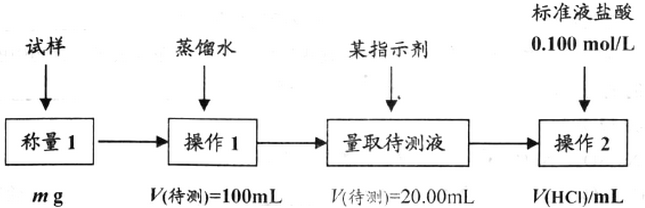
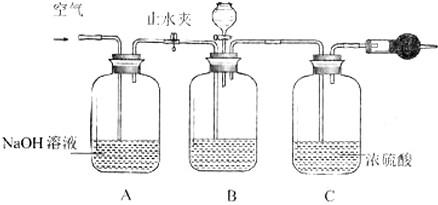
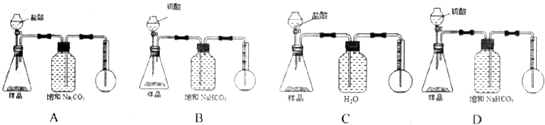
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

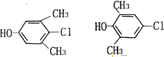 (写两种)
(写两种) 的化学方程式
的化学方程式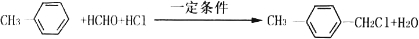 ,
,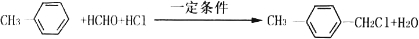 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com